题目内容
20.下列说法正确的是( )| A. | 实验室制取乙烯时浓硫酸是催化剂和吸水剂 | |
| B. | 硝基苯制备时浓硫酸作催化剂和脱水剂 | |
| C. | 实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下 | |
| D. | 水浴加热的优点是可以受热均匀且便于控制温度 |
分析 A.乙醇在浓硫酸做催化剂和脱水剂条件下迅速加热到170度,发生消去反应生成乙烯和水;
B.脱水性是按照水分子中氢氧比例夺取其它物质里氢氧原子的性质;
C.实验室制苯磺酸可直接加热;
D.水浴法物体的温度变化比较均匀,并且变化比较慢.
解答 解:A.实验室制取乙烯的实验中,浓硫酸作催化剂、脱水剂,故A错误;
B.硝基苯制备时浓硫酸作催化剂和吸水剂,故B错误;
C.实验室制苯磺酸可直接加热,不需要测量温度,故C错误;
D.水浴法物体的温度变化比较均匀,并且变化比较慢,便于控制温度,故D正确.
故选D.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
10.38.4g铜和适量的浓硝酸反应,铜全部反应后,共收集到22.4L(标准状况下)NO和NO2混合气体,反应消耗的硝酸可能是( )
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
8.把下列四种溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢反应,其中反应最快的是( )
| A. | 10℃15mL、3mol•L-1的X溶液 | B. | 10℃30mL、1mol•L-1 的X溶液 | ||
| C. | 10℃30mL、2 mol•L-1 的X溶液 | D. | 10℃10mL、4mol•L-1 的X溶液 |
15.下列情况下平衡一定发生移动的是( )
| A. | 混合物中各组分的浓度改变 | B. | 正、逆反应速率改变 | ||
| C. | 平衡体系的温度改变 | D. | 混合气体的压强改变 |
5.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插
入一支温度计,温度计的温度由20℃逐渐升至75℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
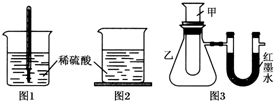
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是放热(填“吸热”或“放热”)反应,写 出该反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(2)方案一中,温度升至最大值后又下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(3)方案二中,小木片脱落的原因是蜡烛熔化,由此得出的结论是氢氧化钠与硫酸的反应放热.
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边低于(填“高于”“低于”或“等于”)右边.
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是红墨水液面左右相平.
(6)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插
入一支温度计,温度计的温度由20℃逐渐升至75℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.

方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)铝片与稀硫酸的反应是放热(填“吸热”或“放热”)反应,写 出该反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(2)方案一中,温度升至最大值后又下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(3)方案二中,小木片脱落的原因是蜡烛熔化,由此得出的结论是氢氧化钠与硫酸的反应放热.
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边低于(填“高于”“低于”或“等于”)右边.
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是红墨水液面左右相平.
(6)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
12.可逆反应H2(g)+I2(g)?2HI(g)达到限度时的标志是( )
| A. | 混合气体密度恒定不变 | B. | 消耗n mol H2同时生成2n mol HI | ||
| C. | H2、I2、HI的浓度相等 | D. | 混合气体的颜色不再改变 |
9.0.1mol阿司匹林[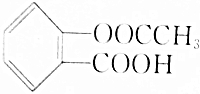 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
10.已知某溶液中加入铝粉产生氢气,在此溶液中肯定能够大量共存的离子组是( )
| A. | SO32-、NO3-、Na+、K+ | B. | Na+、SO42-、Cl-、K+ | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、K+、AlO2-、SO42- |
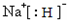 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.