题目内容
下列各组中的两种物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
| A、Al和 NaOH溶液 |
| B、NaOH溶液和AlCl3溶液 |
| C、Na和O2 |
| D、NaOH溶液和CO2 |
考点:钠的重要化合物,钠的化学性质,铝的化学性质
专题:
分析:A.铝与氢氧化钠反应生成偏铝酸钠与氢气;
B.氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
C.钠和氧气在没有条件或燃烧条件时产物不同;
D.氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,二氧化碳过量时生成碳酸氢钠;
B.氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
C.钠和氧气在没有条件或燃烧条件时产物不同;
D.氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,二氧化碳过量时生成碳酸氢钠;
解答:
解:A.铝与氢氧化钠反应生成偏铝酸钠与氢气,故A正确;
B.氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故B错误;
C.钠和氧气在没有条件的条件下反应生成氧化钠,钠在空气中燃烧生成过氧化钠,故C错误;
D.氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,二氧化碳过量时生成碳酸氢钠,反应物用量比改变,会引起产物的种类改变,故D错误;
故选A.
B.氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,故B错误;
C.钠和氧气在没有条件的条件下反应生成氧化钠,钠在空气中燃烧生成过氧化钠,故C错误;
D.氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,二氧化碳过量时生成碳酸氢钠,反应物用量比改变,会引起产物的种类改变,故D错误;
故选A.
点评:本题考查了反应物间反应条件或反应物用量与反应产物的联系,题目难度不大,注意把握常见元素化合物的性质.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
在用锌片、铜片和稀硫酸组成的原电池装置中,经过-段时间工作后,下列说法正确的是( )
| A、锌片是正极,铜片是负极 |
| B、电子是从锌片通过导线流到铜片上 |
| C、溶液中H+移向锌片被还原变成H2 |
| D、电解液的pH逐渐变小 |
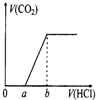 在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )
在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )| A、若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+=HCO3- |
| B、若a:b>l:2,且b=20 mL,则原NaOH溶液的浓度为0.02 mol/L |
| C、若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D、a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )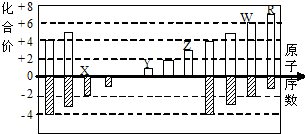

| A、原子半径:R>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、Z能和Y的最高价氧化物对应的水化物反应 |
下列溶液中,一定能大量共存的微粒组是( )
| A、室温下,pH=1的溶液中:Na+、Fe2+、NO-3、SO42- |
| B、由水电离的c(H+)=1×10-13 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
| D、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
常温下,下列物质中能与SiO2发生反应的是( )
| A、硫酸 | B、氢氟酸 | C、水 | D、稀盐酸 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、1 mol Na完全转化为Na2O2时,失去的电子数目为2NA |
| C、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
| D、2L1mol/L Na2SO4溶液中离子总数为3NA |
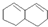 在较高温度下和Br2按物质的量之比1:1发生加成反应的方程
在较高温度下和Br2按物质的量之比1:1发生加成反应的方程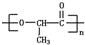 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为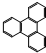 的一氯取代物有
的一氯取代物有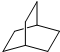 的二氯取代物有
的二氯取代物有