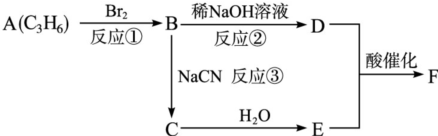
题目内容
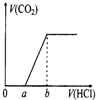 在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )
在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )| A、若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+=HCO3- |
| B、若a:b>l:2,且b=20 mL,则原NaOH溶液的浓度为0.02 mol/L |
| C、若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D、a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
考点:化学方程式的有关计算,离子浓度大小的比较
专题:
分析:假设二氧化碳与氢氧化钠恰好反应生成Na2CO3,向反应后的溶液中滴加盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,则前后两个阶段消耗盐酸体积之比为1:1,当氢氧化钠有剩余时,则前后两个阶段消耗盐酸体积之比大于为1:1,当恰好反应生成Na2CO3、NaHCO3,且二者物质的量之比为1:1时,则前后两个阶段消耗盐酸体积之比为1:2,
A.若a:b<1:2,说明二氧化碳与氢氧化钠恰好反应生成Na2CO3、NaHCO3;
B.若a:b>l:2,且b=20 mL,生成气体最大时,溶液中溶质为NaCl,根据氯离子、钠离子守恒计算n(NaOH),进而计算原溶液中NaOH溶液的浓度;
C.根据质子恒等式进行判断;
D.根据电荷守恒分析判断.
A.若a:b<1:2,说明二氧化碳与氢氧化钠恰好反应生成Na2CO3、NaHCO3;
B.若a:b>l:2,且b=20 mL,生成气体最大时,溶液中溶质为NaCl,根据氯离子、钠离子守恒计算n(NaOH),进而计算原溶液中NaOH溶液的浓度;
C.根据质子恒等式进行判断;
D.根据电荷守恒分析判断.
解答:
解:假设二氧化碳与氢氧化钠恰好反应生成Na2CO3,向反应后的溶液中滴加盐酸,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,则前后两个阶段消耗盐酸体积之比为1:1,当氢氧化钠有剩余时,则前后两个阶段消耗盐酸体积之比大于为1:1,当恰好反应生成Na2CO3、NaHCO3,且二者物质的量之比为1:1时,则前后两个阶段消耗盐酸体积之比为1:2,
A.若a:b<1:2,说明二氧化碳与氢氧化钠恰好反应生成Na2CO3、NaHCO3,则0~a段发生的离子反应为:CO32-+H+=HCO3-,故A正确;
B.若a:b>l:2,且b=20 mL,生成气体最大时,溶液中溶质为NaCl,则n(NaOH)=n(NaCl)=n(HCl)=0.02L×0.1mol/L=0.002mol,原溶液中NaOH溶液的浓度为
=0.02mol/L,故B正确;
C.溶液中氢氧根离子源于水的电离、碳酸根、碳酸氢根的水解,故溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),即c(H+)+c(HCO3-)=c(OH-)-2c(H2CO3),故C错误;
D.根据电荷守恒,阳离子所带电离等于阴离子所带电离,故溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D正确,
故选C.
A.若a:b<1:2,说明二氧化碳与氢氧化钠恰好反应生成Na2CO3、NaHCO3,则0~a段发生的离子反应为:CO32-+H+=HCO3-,故A正确;
B.若a:b>l:2,且b=20 mL,生成气体最大时,溶液中溶质为NaCl,则n(NaOH)=n(NaCl)=n(HCl)=0.02L×0.1mol/L=0.002mol,原溶液中NaOH溶液的浓度为
| 0.002mol |
| 0.1L |
C.溶液中氢氧根离子源于水的电离、碳酸根、碳酸氢根的水解,故溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),即c(H+)+c(HCO3-)=c(OH-)-2c(H2CO3),故C错误;
D.根据电荷守恒,阳离子所带电离等于阴离子所带电离,故溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D正确,
故选C.
点评:本题考查混合物有关计算、离子浓度大小比较,根据消耗盐酸的体积讨论分析图象中各阶段发生的反应是关键,难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
将5.6g铁粉投入盛有100mL 2mol?L-1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A、v(Fe)=0.5 mol?L-1?min-1 |
| B、v(H2SO4)=1 mol?L-1?min-1 |
| C、v(H2)=1 mol?L-1?min-1 |
| D、v(FeSO4)=0.5 mol?L-1?min-1 |
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
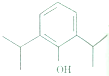 2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )
2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )| A、能发生加成反应 |
| B、能和FeCl3溶液发生显色反应 |
| C、能与Na2CO3溶液发生反应 |
| D、分子中所有碳原子都在同一平面上 |
下列关于热化学反应的描述中正确的是( )
| A、已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-114.6kJ?mol-1 | ||
B、燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
| ||
| C、若常温时H2(g)的燃烧热是285.8 kJ?mol-1,则2H2O(g)=2H2(g)+O2(g)△H=+571.6kJ?mol-1 | ||
| D、常温时葡萄糖的燃烧热是2800 kJ?mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l )△H=-1400 kJ?mol-1 |
下列各组中的两种物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
| A、Al和 NaOH溶液 |
| B、NaOH溶液和AlCl3溶液 |
| C、Na和O2 |
| D、NaOH溶液和CO2 |
下列物质属于不属于混合物的是( )
| A、纯碱 | B、石油 | C、煤 | D、碱石灰 |