题目内容
15.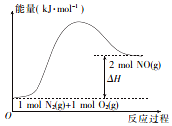 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应过程中有共价键的断裂和形成 | |
| D. | 使用催化剂可以改变反应速率 |
分析 对于反应N2(g)+O2 (g)=2NO(g),反应中N、O元素化合价发生变化,属于氧化还原反应,由图象可知,反应物总能量小于生成物总能量,为吸热反应,以此解答该题.
解答 解:A.由图象可知,反应物总能量小于生成物总能量,为吸热反应,故A错误;
B.反应中N、O元素化合价发生变化,属于氧化还原反应,故B正确;
C.化学反应的实质为共价键的断裂和形成,故C正确;
D.加入催化剂,改变反应的活化能,可改变反应速率,故D正确.
故选A.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化为解答的关键,侧重分析与应用能力的考查,注意图象的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列关于氢化物的叙述正确的是( )
| A. | 沸点:H2S>HF | B. | 稳定性:H2S<HF | ||
| C. | 一个D2O分子中所含的中子数为8 | D. | HCl的电子式为H+[:Cl:]- |
6. 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
⑥可能有C3H4
则上述对该混合烃的判断正确的是( )
 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
⑥可能有C3H4
则上述对该混合烃的判断正确的是( )
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
3.下面的排序不正确的是( )
| A. | 晶体熔点的高低: > > | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
10. 在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
 在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )| A. | 碳棒上有气体放出,溶液c(H+)减小 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极到b极 | |
| D. | a极上发生了氧化反应 |
20.下列关于化学反应速率的说法中,不正确的是( )
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 |
7.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 11.2 LNH3所含分子数为0.5NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 23g金属钠与氧气加热生成Na2O2的反应,转移的电子数为2NA | |
| D. | 5.6g铁与足量的盐酸反应,失去的电子数为0.2NA |
8. (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
H2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{C}^{2}({N}_{2}{O}_{5})}{{C}^{4}(N{O}_{2})×C({O}_{2})}$,已知:K300℃>K350℃,则该反应是放热反应
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
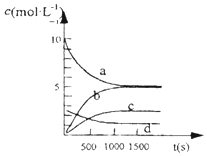
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/molH2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
9.胶体与溶液的本质区别是( )
| A. | 是否属于混合物 | B. | 是否无色透明 | ||
| C. | 分散质粒子直径大小 | D. | 有无丁达尔效应 |