题目内容
14.原子序数依次递增的U、V、W、X、Y是周期表中前30号元素.已知U的最外层电子数是其内层电子数的2倍;U与W形成的常见化合物之一是主要的温室气体;X与U同主族,其单质在同周期元素所形成的单质中熔点最高;Y原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:(1)V在周期表中的位置是第二周期第ⅤA族,该主族元素的气态氢化物中,沸点最低的是PH3(填化学式).
(2)根据等电子原理分析,VW2+中V原子的轨道杂化类型是sp.
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是原子晶体.
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测X元素的电离能突增应出现在第五电离能.
(5)U的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为5:1.
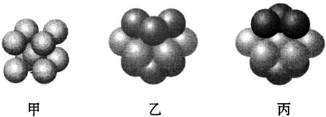
(6)Y的基态原子有3种形状不同的原子轨道;Y2+的价电子排布式为3d9;如图丙(填“甲”“乙”或“丙”)表示的是Y晶体中微粒的堆积方式.
分析 原子序数依次递增的U、V、W、X、Y是周期表中前30号元素.已知U的最外层电子数是其内层电子数的2倍,U原子只能有2个电子层,最外层电子数为4,则U为碳元素;U与W形成的常见化合物之一是主要的温室气体,则W为O元素;结合原子序数可知V为N元素;X与U同主族,其单质在同周期元素所形成的单质中熔点最高,则X为Si;Y原子M能层为全充满状态,且核外的未成对电子只有一个,其原子核外电子排布为1s22s22p63s23p63d104s1,则Y为Cu,据此进行解答.
解答 解:原子序数依次递增的U、V、W、X、Y是周期表中前30号元素.已知U的最外层电子数是其内层电子数的2倍,U原子只能有2个电子层,最外层电子数为4,则U为碳元素;U与W形成的常见化合物之一是主要的温室气体,则W为O元素;结合原子序数可知V为N元素;X与U同主族,其单质在同周期元素所形成的单质中熔点最高,则X为Si;Y原子M能层为全充满状态,且核外的未成对电子只有一个,其原子核外电子排布为1s22s22p63s23p63d104s1,则Y为Cu,
(1)V为N元素,在周期表中的位置是:第二周期第ⅤA族,该主族元素的气态氢化物中,沸点最低的是PH3,
故答案为:第二周期第ⅤA族;PH3;
(2)VW2+为NO2+,NO2+与CO2为等电子体,根据等电子原理可知,N原子与C原子的杂化发生相同,CO2分子为直线型结构,C原子采取sp杂化,故NO2+中N原子为sp杂化,
故答案为:sp;
(3)五种元素中,电负性最大为O,最小的非金属元素为Si,二者形成的化合物为SiO2,其晶体是原子晶体,
故答案为:原子晶体;
(4)Si元素原子1s22s22p63s23p2,第三能层4个电子能量相差不是很大,与第二能层的电子能量相差较大,故其电离能突增应出现在第五电离能,
故答案为:五;
(5)C元素的一种相对分子质量为28的氢化物为C2H4,结构简式为CH2=CH2,含有4个C-H间、1个C=C双键,单键为σ键,双键含有1个σ键与1个π键,故其分子中σ键与π键的个数之比为 5:1,
故答案为:5:1;
(6)Cu的基态原子核外电子排布为1s22s22p63s23p63d104s1,有3种形状不同的原子轨道;Cu2+的价电子排布式为3d9;Cu晶体属于面心立方最密堆积,为ABC排列方式,故图丙符合,
故答案为:3;3d9;丙.
点评 本题考查物质结构与性质的综合应用,题目难度中等,涉及核外电子排布、等电子体、电离能、化学键、晶胞结构等知识,(5)(6)中晶胞问题为易错点,要熟记中学常见的晶胞结构,试题培养了学生的分析能力及灵活应用能力.

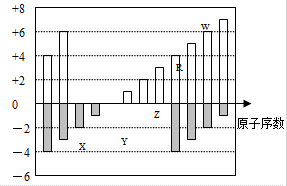
| A. | 单质的氧化性:X>R>W | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一定不能与铜反应 | |
| D. | 离子的氧化性:Z>Y |
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)>c(CH3COO -) | |
| C. | 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4)2SO4>c(NH4Cl) |
| A. | 碘酒是指碘单质的乙醇溶液 | |
| B. | 浓硫酸可以刻蚀石英制艺术品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氢氧化铝、小苏打等可用于治疗胃酸过多 |
| A. | 45mL | B. | 180mL | C. | 90mL | D. | 135mL |
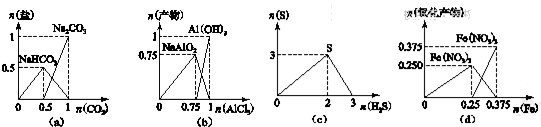
| A. | 图(a):n(NaOH)═1 mol时,CO2和NaOH溶液反应生成的盐 | |
| B. | 图(b):n(NaOH)═3 mol时,AlCl3溶液和NaOH 溶液反应的产物 | |
| C. | 图(c):n(H2S)+n(SO2)═3 mol时,H2S与SO2反应生成的S | |
| D. | 图(d):n(HNO3)═1 mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |