题目内容
4.下列图象不能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )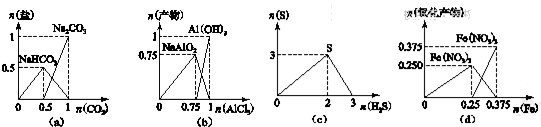
| A. | 图(a):n(NaOH)═1 mol时,CO2和NaOH溶液反应生成的盐 | |
| B. | 图(b):n(NaOH)═3 mol时,AlCl3溶液和NaOH 溶液反应的产物 | |
| C. | 图(c):n(H2S)+n(SO2)═3 mol时,H2S与SO2反应生成的S | |
| D. | 图(d):n(HNO3)═1 mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
分析 A.CO2逐步通入到NaOH溶液中,发生CO2+2NaOH═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3;
B.NaOH 溶液中逐渐加入AlCl3,开始NaOH过量,生成偏铝酸钠,NaOH完全反应后,偏铝酸钠与AlCl3溶反应生成氢氧化铝沉淀;
C.H2S与SO2反应生成的S,H2S过量时,沉淀不减少;
D.Fe和稀HNO3反应时,铁少量时发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,全部转化为三价铁后继续加人铁,则发生Fe+2Fe(NO3)3═3Fe(NO3)2.
解答 解:A.因开始碱过量,则发生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol时生成0.5molNa2CO3,再加人二氧化碳发生Na2CO3+H2O+CO2═2NaHCO3,则最终碳酸钠减少为0,碳酸氢钠生成1mol,图象与反应不符,故A错误;
B.NaOH 溶液中逐渐加入AlCl3,开始NaOH过量,生成偏铝酸钠,3molNaOH与0.75molAlCl3完全反应生成0.75molNaAlO2,然后偏铝酸钠与AlCl3溶反应生成氢氧化铝沉淀,0.75molNaAlO2与0.25molAlCl3恰好完全反应,故B正确;
C.H2S与SO2反应生成的S,由于S与H2S不反应,所以H2S过量时,沉淀不减少,故C错误;
D.因开始硝酸过量,则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,n(HNO3)=1mol时生成0.25molFe(NO3)3,图象与反应不符,故D错误;
故选B.
点评 本题考查化学反应与图象的关系,把握图象中的线、点的意义及对应的化学反应是解答本题的关键,并注意反应物的量对反应的影响来分析反应的产物,题目难度中等.

练习册系列答案
相关题目
15.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
19.关于如图装置所示的两个实验,说法正确的是( )
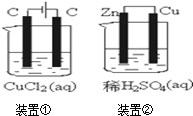

| A. | 两个装置中都发生了化学变化,都由化学能转变为电能 | |
| B. | 装置②中电流方向是从Zn经导线流入Cu | |
| C. | 反应开始阶段,两个装置中均有氢气产生 | |
| D. | 电极反应式:阳极2Cl--2e-→Cl2↑正极2H++2e-→H2↑ |
9.下列情况中属于离子反应的是( )
| A. | H2和O2反应生成了H2O | B. | Zn粒投入稀硫酸中 | ||
| C. | KMnO4加热制O2 | D. | C和O2反应生成CO2 |
16.下列反应属于取代反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
13.下列应用与盐类的水解无关的是( )
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
14.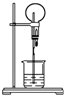 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |