题目内容
8.锰(Mn)、钴(Co)都是重要的过渡元素,其氧化物常用作化学反应中的催化剂.I、
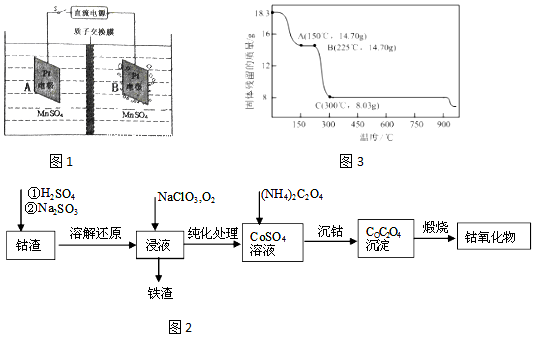
(1)工业上用图1所示装置制备MnO2.接通电源后,A电极的电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,当生成1mol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为89g.
(2)已知25℃、101kPa时,Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1,则SO2与MnO2反应生成无水MnSO4的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
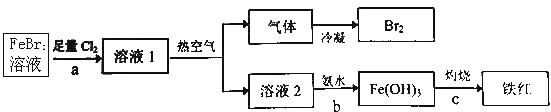
II、利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如图2:
(1)溶解还原过程中Co(OH)3发生反应的离子方程式为2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;
(2)铁渣中铁元素的化合价为+3;
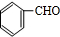
(3)CoC2O4是制备钴的氧化物的重要原料.二水合草酸钴(CoC2O4•2H2O)在空气中受热 的质量变化曲线如图3所示,曲线中300℃及300℃以上所得固体均为钴氧化物.
①通过计算确定C点剩余固体的化学成分为Co3O4(填化学式);
②写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2.
分析 Ⅰ(1)由装置图可知,B电极上有气体生成,发生还原反应,应是氢离子放电生成氢气,A为阳极,阳极上是Mn2+失去电子得到MnO2,由电荷守恒可知还有H+生成,氢离子通过质子交换膜移向右室,根据电子转移可知移向右室的氢离子生成氢气,右室电解质溶液质量不变,两侧电解液的质量变化差为二氧化锰与移向右室氢离子的质量;
(2)已知:①Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
②S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
由盖斯定律③-②-①可得;
Ⅱ钴渣[含Co(OH)3、Fe(OH)3等]用硫酸和亚硫酸钠浸液,Co(OH)3、Fe(OH)3溶解,2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;Fe(OH)3加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气、加入氯酸钠除铁,纯化处理,加入碳酸氢铵,得到CoCO3沉淀,煅烧后得到钴的氧化物,据此分析.
解答 解:I (1)由装置图可知,B电极上有气体生成,发生还原反应,应是氢离子放电生成氢气,A为阳极,阳极上是Mn2+失去电子得到MnO2,由电荷守恒可知还有H+生成,氢离子通过质子交换膜移向右室,阳极电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,根据电子转移可知移向右室的氢离子生成氢气,右室电解质溶液质量不变,两侧电解液的质量变化差为二氧化锰与移向右室氢离子的质量,当制备1mol MnO2,转移电子为2mol,则移向右室的氢离子为2mol,则膜两侧电解液的质量变化差(△m左-△m右)为1mol×87g/mol+2mol×1g/mol=89g,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;89;
(2)已知:①Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
②S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
由盖斯定律③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
II(1)Co(OH)3溶解还原反应为Co(OH)3、H+、SO32-的氧化还原反应,其离子反应为2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;
故答案为:2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;
(2)由制备流程可知,加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气时亚铁离子被氧化为铁离子,可知铁渣中铁元素的化合价为+3价;
故答案为:+3;
(3)①由图可知,CoC2O4•2H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,C的Co氧化物为Co3O4;
B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2,
故答案为:Co3O4;3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2.
点评 本题考查物质的制备、盖斯定律、化学反应图象的有关进行计算,关键是根据质量分析各点物质的成分,注意利用守恒法计算,避免计算繁琐,需要学生具备知识的基础,难度中等.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )| 选项 | ① | ② | ③ | ④ |
| A | 醋酸水溶液 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓盐酸 | 浓硫酸 | 石蕊溶液 | 出现红色 |
| D | 浓盐酸 | Na2CO3 | CaCl2溶液 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  过滤 | B. |  检查容量瓶是否漏水 | ||
| C. |  气密性检查 | D. |  蒸发 |
①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出金属离子和酸根离子的化合物都是盐
③金属氧化物一定是碱性氧化物
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌( )
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②⑤ |

| A. | a、b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硫酸 | |
| C. | 该装置可能是Cu-Ag原电池,电解质溶液为稀硝酸 | |
| D. | 该装置中通过2 mol电子时,溶液质量增加62g |

 RCHO$→_{△}^{H_{2}O/H+}$
RCHO$→_{△}^{H_{2}O/H+}$
 $\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)
$\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基) .
. +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+ +H2O.
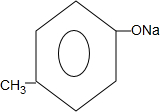
+H2O. 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式:
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
. )的路线(其他无机试剂任选).合成路线流程图示例如下:
)的路线(其他无机试剂任选).合成路线流程图示例如下: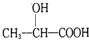 .
.
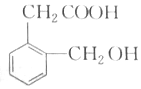 ),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.
),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.