题目内容
20.有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如图.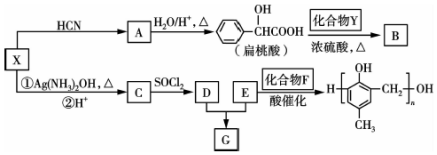
已知以下信息:
①RCHO$\stackrel{HCN}{→}$
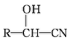 RCHO$→_{△}^{H_{2}O/H+}$
RCHO$→_{△}^{H_{2}O/H+}$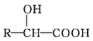
②RCOOH$\stackrel{SOCl_{2}}{→}$
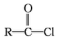 $\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)
$\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)③X在催化剂作用下可与H2反应生成化合物Y.
④化合物F的核磁共振氢谱图中只有一个吸收峰.
回答下列问题:
(1)X中含氧官能团的名称是醛基,X与HCN反应生成A的反应类型是加成反应.
(2)酯类化合物B的分子式是C15H14O3,其结构简式是
 .
.(3)X发生银镜反应的化学方程式是
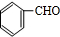 +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.(4)G在NaOH溶液中发生水解反应的化学方程式是
 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+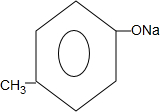 +H2O.
+H2O.(5)
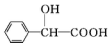 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式:
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
.(6)写出以C2H5OH为原料合成乳酸(
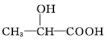 )的路线(其他无机试剂任选).合成路线流程图示例如下:
)的路线(其他无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{2}COOH}$CH3COOCH2CH3C2H5OH$→_{△}^{O_{2}/Cu}$CH3CHO$\stackrel{HCN}{→}$CH3CH(OH)CN$→_{△}^{H_{2}O/H+}$
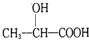 .
.
分析 X可以发生银镜反应,则X含有醛基,X与HCN发生加成反应生成A,A在酸性条件下水解生成扁桃酸,结合扁桃酸的结构简式,可知X为 ,A为
,A为 ,X在催化剂作用下可与H2反应生成化合物Y,Y与扁桃酸发生酯化反应生成酯类化合物B的分子式是C15H14O3,可知Y为
,X在催化剂作用下可与H2反应生成化合物Y,Y与扁桃酸发生酯化反应生成酯类化合物B的分子式是C15H14O3,可知Y为 ,则B为
,则B为 .X发生氧化反应,然后酸化得到C为
.X发生氧化反应,然后酸化得到C为 ,C与SOCl2发生信息中取代反应生成D为
,C与SOCl2发生信息中取代反应生成D为 .化合物F的核磁共振氢谱图中只有一个吸收峰,结合E与F缩聚反应产物结构简式,可知F为HCHO,E为
.化合物F的核磁共振氢谱图中只有一个吸收峰,结合E与F缩聚反应产物结构简式,可知F为HCHO,E为 ,则G为
,则G为 .
.
解答 解:(1)X为 ,含氧官能团的名称是醛基,X与HCN反应生成A的反应类型是加成反应,故答案为:醛基;加成反应;
,含氧官能团的名称是醛基,X与HCN反应生成A的反应类型是加成反应,故答案为:醛基;加成反应;
(2)由上述分析可知,化合物B的结构简式是: ,故答案为:
,故答案为: ;
;
(3)X发生银镜反应的化学方程式是 +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O,
+2Ag↓+3NH3+H2O,
故答案为: +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(4)G在NaOH溶液中发生水解反应的化学方程式是: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+ +H2O,
+H2O,
故答案为: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+ +H2O;
+H2O;
(5)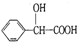 的同分异构体中:①能发生水解反应,说明含有酯基,②能发生银镜反应,含有甲酸形成的酯基,③能与氯化铁溶液发生显色反应,说明含有酚羟基,④含氧官能团处在对位,可以还含有1个甲基,有2种位置关系,或者为-OH、-CH2OOCH处于对位,满足上述条件的同分异构体共有3种(不考虑立体异构),核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式为
的同分异构体中:①能发生水解反应,说明含有酯基,②能发生银镜反应,含有甲酸形成的酯基,③能与氯化铁溶液发生显色反应,说明含有酚羟基,④含氧官能团处在对位,可以还含有1个甲基,有2种位置关系,或者为-OH、-CH2OOCH处于对位,满足上述条件的同分异构体共有3种(不考虑立体异构),核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式为 ,
,
故答案为:3; ;
;
(6)C2H5OH发生催化氧化生成CH3CHO,然后与HCN发生加成反应生成CH3CH(OH)CN,最后在酸性条件下水解生成 ,合成类型流程图为:C2H5OH$→_{△}^{O_{2}/Cu}$CH3CHO$\stackrel{HCN}{→}$CH3CH(OH)CN$→_{△}^{H_{2}O/H+}$
,合成类型流程图为:C2H5OH$→_{△}^{O_{2}/Cu}$CH3CHO$\stackrel{HCN}{→}$CH3CH(OH)CN$→_{△}^{H_{2}O/H+}$ ,
,
故答案为:C2H5OH$→_{△}^{O_{2}/Cu}$CH3CHO$\stackrel{HCN}{→}$CH3CH(OH)CN$→_{△}^{H_{2}O/H+}$ .
.
点评 本题考查有机物的推断与合成,充分利用转化中物质的结构、反应条件及给予的信息进行推断,较好地考查学生分析推理能力、自学能力、知识迁移运用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |
| A. | 升高温度,正反应速率减慢,逆反应速率加快,化学平衡向逆反应方向移动 | |
| B. | 增大压强,正反应与逆反应速率均增大,平衡不移动 | |
| C. | 增大A2(g)的浓度,化学平衡向正反应方向移动,A2的转化率增大 | |
| D. | 增大B的物质的量,化学平衡向正反应方向移动,A2的转化率增大 |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某溶液中加入盐酸,有气体生成,气体能使澄清石灰水变浑浊 | 该溶液中有CO32- |
| B | 向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失 | 该原溶液一定含有SO42- |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入NaOH溶液并加热,有气体产生,用湿润的红色石蕊试纸,试纸显蓝色 | 说明该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题: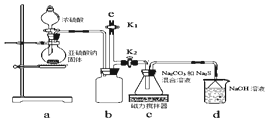 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.