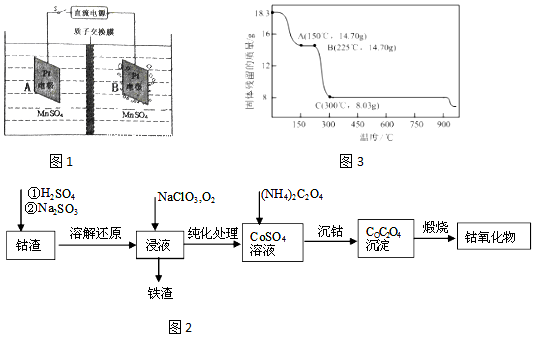
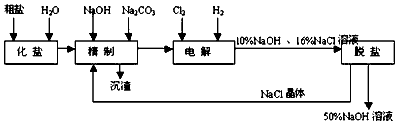
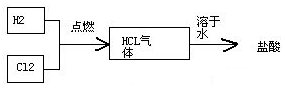
题目内容
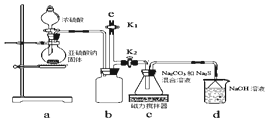
3.以FeBr2溶液为原料回收溴,并制取铁红,某同学设计的实验方案如图: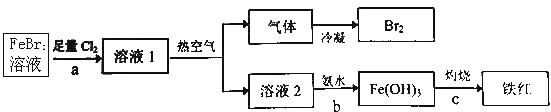
请回答:
(1)a过程反应的离子方程式2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
(2)热空气的作用是从溶液中吹出溴蒸气.
(3)b过程反应的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
分析 溴化亚铁溶液中通入足量氯气反应生成氯化铁、溴单质的溶液1,溶液1中通入热空气吹出溴单质冷凝得到液溴,溶液2主要为氯化铁溶液加入氨水过滤得到氢氧化铁沉淀,灼烧得到氧化铁,
(1)a过程是足量氯气氧化亚铁离子和溴离子生成铁离子和溴单质;
(2)热空气是利用溴的挥发性,从溶液中吹出溴单质;
(3)b过程是氯化铁溶液和一水合氨反应生成氢氧化铁沉淀和氯化铵.
解答 解:(1)a过程是足量氯气氧化亚铁离子和溴离子生成铁离子和溴单质,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,
故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
(2)热空气是利用溴的挥发性,从溶液中吹出溴单质,热空气的作用是:从溶液中吹出溴蒸气,故答案为:从溶液中吹出溴蒸气;
(3)b过程是氯化铁溶液和一水合氨反应生成氢氧化铁沉淀和氯化铵,反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
点评 本题考查了物质性质、转化关系、反应产物产物和反应过程的分析判断,注意铁及其化合物性质和溴单质制备的原理的掌握,题目难度不大.

练习册系列答案
相关题目
15.下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某溶液中加入盐酸,有气体生成,气体能使澄清石灰水变浑浊 | 该溶液中有CO32- |
| B | 向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失 | 该原溶液一定含有SO42- |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入NaOH溶液并加热,有气体产生,用湿润的红色石蕊试纸,试纸显蓝色 | 说明该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
19.几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2.据此判断下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | H2O2+H2SO4=SO2↑+O2↑+2H2O | ||
| C. | SO2+I2+2H2O=H2SO4+2HI | D. | 2Fe3++2I-=2Fe2++I2 |
15.在密闭容器中,将2.0mol CO与10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率( )
| A. | 83% | B. | 17% | C. | 50% | D. | 60% |
13.下列化学反应中,能用离子方程式 H++OH-═H2O 表示的是( )
| A. | 2H2+O2═2H2O | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2HCl+Cu(OH)2═CuCl2+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
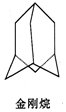 金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.
金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.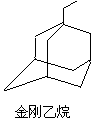 $→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$
$→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$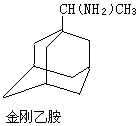
 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.