题目内容
18.如图所示装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法错误的是( )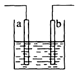
| A. | a、b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硫酸 | |
| C. | 该装置可能是Cu-Ag原电池,电解质溶液为稀硝酸 | |
| D. | 该装置中通过2 mol电子时,溶液质量增加62g |
分析 铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
解答 解:铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
A.该装置是电解池,a、b材料可能是同种材料,故A正确;
B.该反应不能自发进行,所以只能设计成电解池,电解质溶液为稀硫酸,故B正确;
C.硝酸和铜反应生成氮氧化物而不生成氢气,故C错误;
D.该装置中通过2 mol电子时,溶液质量增加(64-2)=62g,故D正确;
故选C.
点评 本题考查了原电池和电解池原理,根据电池反应式是否自发进行确定为哪种类型的电池,再结合电解池反应来分析解答,知道离子的放电顺序,注意:活泼金属作电解池阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
9.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%.在用CH3C≡CH合成CH2═C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
13.下列化学反应中,能用离子方程式 H++OH-═H2O 表示的是( )
| A. | 2H2+O2═2H2O | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2HCl+Cu(OH)2═CuCl2+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
3.在温度和容积不变的条件下,发生反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),能表明反应达到平衡状态的叙述是 ( )
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
10.下列物质中属于电解质的是( )
| A. | 硫酸钡 | B. | 氯化钠溶液 | C. | 二氧化硫 | D. | 金属铜 |
7.下列离子方程式书写正确的是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
8.物质的量浓度相同的下列溶液中,符合PH由小到大顺序排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2CO3 | |
| D. | (NH4)2SO4 NH4Cl NaNO3 Na2S |
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③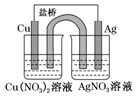 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.