题目内容
9.在水中加入等物质的量的Ag+、Na+、Ba2+、NO3-、SO42-、Cl-,该溶液放在惰性电极的电解槽内,通电一段时间后,则氧化产物与还原产物的质量比为( )| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
分析 在水中加入物质的量相等的Ag+、Ba2+、Na+、SO42-、NO3-,Ag+和Cl-结合为AgCl沉淀,Ba2+ 和SO42-结合为BaSO4沉淀,溶液中就只有Na+、NO3-,实际上是电解NaNO3溶液,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,结合电解方程式计算.
解答 解:在水中加入物质的量相等的Ag+、Ba2+、Na+、SO42-、NO3-,Ag+和Cl-结合为AgCl沉淀,Ba2+ 和SO42-结合为BaSO4沉淀,溶液中就只有Na+、NO3-,实际上是电解NaNO3溶液,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,氧化产物是氧气、还原产物是氢气,电解方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,则氧化产物与还原产物物质的量之比32:4=8:1,
故选C.
点评 本题考查电解原理和离子共存,为高频考点,明确溶液中的溶质是解本题关键,主要根据离子放电顺序确定阴阳极上产物,因为漏掉了离子共存而导致错误,为易错题,题目难度不大

练习册系列答案
相关题目
1.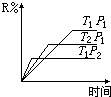 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
18.四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍.下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 四种短周期元素中W的原子半径最小 | |
| B. | Z元素在周期表中的位置是第三周期第ⅣA族 | |
| C. | 原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z | |
| D. | 元素非金属性由强到弱的顺序:W>Z,W的单质常温下可与氢氧化钠溶液反应 |
5.常温下,下列溶液中微粒的物质的量浓度关系不正确的( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | 常温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 浓度均为0.1mol/L的①NH4Cl ②NH3•H2O ③NH4HSO4 ④NH4HCO3四种溶液,c(NH4+)由大到小的顺序为:③>①>④>② |
1.下列离子在溶液中能大量共存的是( )
| A. | Cu2+ Na+ NO3- S2- | B. | Mg2+ H+ SO42- NO3- | ||
| C. | Al3+ Na+ HCO3- SO42- | D. | Fe3+ H+ SCN- Cl- |
4.0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,若溶液温度从室温升高到60℃,则溶液( )
| A. | pH增大 | B. | c(CH3COOH)增大 | ||
| C. | CH3COOH电离程度增大 | D. | c(H+)×c(OH-)=1×10-14 |
 回答下列问题.
回答下列问题.