题目内容
19.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状 |
| C | SiO2有导电性 | SiO2可用于制备光导纤维 |
| D | 铝制品在空气中耐腐蚀 | 铝是不活泼金属 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KSCN与三价铁离子发生络合反应生成血红色络合物;
B.浓硫酸滴到湿润的蔗糖中,浓硫酸使蔗糖脱水变成黑色的炭,炭与浓硫酸发生氧化还原反应产生二氧化碳,使蔗糖呈海绵状;
C.二氧化硅不导电;
D.铝性质活泼,空气中被氧气氧化生成氧化膜.
解答 解:A.KSCN与三价铁离子发生络合反应生成血红色络合物,该反应中没有元素化合价变化,不是氧化还原反应,故A错误;
B.浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状,体现浓硫酸的脱水性和强氧化性,故B正确;
C.SiO2可用于制备光导纤维,是因为二氧化硅具有良好的光学特性,与导电性无关,故C错误;
D.铝性质活泼,空气中被氧气氧化生成氧化膜,阻止反应进行,故D错误;
故选:B.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将碳酸氢钠分解产生的气体通入CaCl2溶液 | 产生白色沉淀 | CO2与CaCl2溶液反应 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将水蒸气通过灼热的铁粉 | 有黑色晶体生成 | 铁与水在高温下发生反应 |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为浅色蓝色沉淀 | Mg(OH)2的溶度积(Ksp)比Cu(OH)2小 |
| A. | A | B. | B | C. | C | D. | D |
10.铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5KJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5KJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
①T2℃时,容器1中反应的平衡常数K1=64.
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是D(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示.
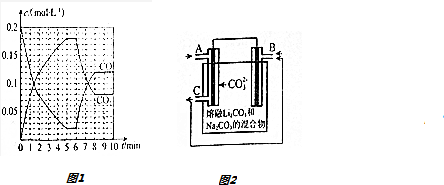
①6min时,改变的外界条件未升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)<(选填“>”“<”或“=”)v(逆).
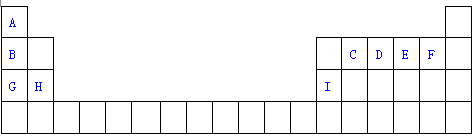
(5)CO-O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole-,理论上C口被分离出的气体的物质的量最多为1mol.
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5KJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5KJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是D(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示.

①6min时,改变的外界条件未升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)<(选填“>”“<”或“=”)v(逆).
(5)CO-O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole-,理论上C口被分离出的气体的物质的量最多为1mol.
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出热量9.2KJ时,转移电子0.6 NA | |
| B. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| C. | 标准状况下,11.2L苯中含有碳氢键的数目为3NA | |
| D. | 0.1mol H2O2分子中含极性共价键数目为0.3NA |
11.满足分子式为C5H11Cl的有机物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
 可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯
可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯 .
. ,
, .
.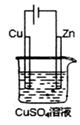 如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.
如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.