题目内容
8.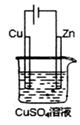 如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.
如图是一个电解过程示意图.假设使用N2H4-空气燃料电池作为本过程的电源,铜片质量变化128g,则N2H4一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)112L.
分析 电解时,与电源正极相连的是电解池的阳极,铜失电子发生氧化反应,铜失去的电子与燃料电池中转移电子总数相等,从而计算需要空气的体积.
解答 解:铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,铜的物质的量为2mol,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即5mol×22.4L/mol=112L,
故答案为:112.
点评 本题考查电解池与燃料电池电极反应及其计算,抓住电子转移守恒是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状 |
| C | SiO2有导电性 | SiO2可用于制备光导纤维 |
| D | 铝制品在空气中耐腐蚀 | 铝是不活泼金属 |
| A. | A | B. | B | C. | C | D. | D |
3.盛装下列溶液的试剂瓶使用橡胶塞的是( )
| A. | 硫酸 | B. | NaOH溶液 | C. | 盐酸 | D. | NaCl溶液 |
13.将一小块金属钠投入一无色水溶液中,既能生成气体,又能生成沉淀的是( )
| A. | CuCl2 | B. | FeCl3 | C. | MgSO4 | D. | BaCl2 |
20.下列关于物质结构的说法正确的为( )
| A. | 分子中一定含有共价键 | |
| B. | 区分离子化合物和共价化合物的方法是看其水溶液是否能导电 | |
| C. | 离子化合物只含离子键 | |
| D. | 离子化合物在熔融状态能够电离出自由移动的离子,而共价化合物不能 |
17.有四种有机物①(CH3)2CHCH(CH3)2,②(CH3)2C(CH3)2,③CH3(CH2)2CH(CH3)2,④CH3CH2C(CH3)3 有关四种物质的下列叙述中正确的是( )
| A. | 能通过加氢反应得到③的烯烃有四种 | |
| B. | ①和②互为同分异构体,①和④互为同系物 | |
| C. | ②可以由烯烃与氢气加成而获得 | |
| D. | ④的一氯代物有四种 |
18.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.6gCaCO3与Mg3N2的混合物所含质子数为0.3NA | |
| B. | 0.3mol/L的Na2SO4溶液中含有Na+和SO42-的总数目为0.9NA | |
| C. | 标准状况下,22.4LCCl4所含的氯原子数目为4NA | |
| D. | 1molNa2O2与足量的H2O完全反应时转移的电子数为2NA |
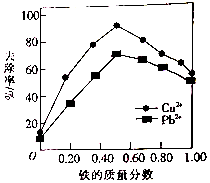 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
 .
.