题目内容
3.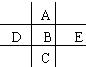 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:(1)C位于第四周期,第VIA族.
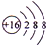
(2)B的离子结构示意图
 .A单质的电子式为
.A单质的电子式为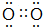 .
.(3)D、B、E的三种元素形成的单质中,氧化性最强的是:Cl2(填化学式).A、B、的气态氢化物热稳定性最强的是HCl(填化学式).
(4)D的气态氢化物的结构式为
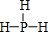 .
.
分析 B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+48}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素,根据元素周期律的递变规律判断对应化合物的性质.
解答 解:B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+48}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素.
(1)C为Se元素,位于第四周期VIA族,故答案为:四;VIA;
(2)B的离子为S2-,离子结构示意图为 ,A单质为O2,电子式为
,A单质为O2,电子式为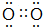 ,故答案为:
,故答案为: ;
;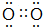 ;
;
(3)非金属性Cl>S>P,氧化性最强的是:Cl2,氢化物稳定性最强的是HCl,故答案为:Cl2;HCl;
(4)D的气态氢化物为PH3,结构式为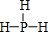 ,故答案为:
,故答案为: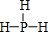 .
.
点评 本题考查位置结构性质的相互关系,注意根据元素在周期表中的位置结合化合价特点进行推断,旨在考查学生对基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列溶液蒸干灼烧所得固体成分正确的是( )
| A. | NaAlO2溶液--------氧化铝 | B. | 次氯酸钠---------氯化钠 | ||
| C. | 碳酸氢镁--------碳酸镁 | D. | 硫酸铜--------氧化铜 |
14.下列叙述正确的是( )
| A. | 在铁件上镀铜时,金属铜作阴极 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为CH3OH+6OH-+6e-═CO2+5H2O | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
11.化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列实验操作正确的是( )
| A. | 蒸馏液体时,冷水应从冷凝管的上端进入,下端流出,符合水往低处流原理 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧靠烧杯内壁 | |
| C. | 进行蒸发操作时,待固体全部析出时再停止加热 | |
| D. | 分液时,当静置分层后,打开旋塞,使下层液体流出,待下层液刚好流尽后,立即关闭旋塞,再换另一只烧杯,再打开旋塞,将上层液体流出 |
8.1.52g铜镁合金完全溶解50mL密度为1.40g•ml-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54g沉淀时,加入Na0H溶液的体积是600ml | |
| B. | 该浓硝酸稀释至100mL时,HNO3的物质的量浓度是7mol•L-1 | |
| C. | 该合金中镁与铜的质量之比是3:16 | |
| D. | NO2和N2O4的混合气体中,N2O4的物质的量是0.01mol |
15.具有9个质子和10个电子的微粒是( )
| A. | Na+ | B. | O2- | C. | F- | D. | Ne |
12.下列关于催化剂的说法,不正确的是( )
| A. | 催化剂不能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |
13.工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )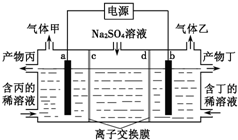

| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
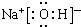 .AB-离子的电子式为
.AB-离子的电子式为 .
.