题目内容
9. 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1(1)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530kJ•mol-1.
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.
 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约72.6kJ;
②H-O 键比H-N键(填“强”或“弱”)强.
(3)如图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
①图中b点,v(正)>v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=1:4.
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是2NH3+3O2 $\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O.
(5)电解法能将碱性溶液中的NO2-转化为N2而除去,其电极反应式是2NO2-+6e-+4H2O=N2↑+8OH-.
分析 (1)将已知热化学方程式和氢气的燃烧热的热化学方程式,综合利用盖斯定律求解;
(2)①根据物质的键能变化计算;
②根据键能的差值,判断键的强弱;
(3)①根据反应的方向,判断正逆反应速率的大小;
②根据氨气的体积分数计算n(N2):n(NH3);
(4)水中的氧气氧化氨气生成亚硝酸和水;
(5)电解法能将碱性溶液中的NO2-转化为N2和OH-.
解答 解:(1)NH3(g)在纯氧中燃烧生成无毒、无害物质量氮气,的热化学方程式,实际上是考查盖斯定律的应用,根据H2(g)的燃烧热为285.8kJ•mol-1,即H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1…①,再结合已知的:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1…②
(①×3-②)×2即可得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ•mol -1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ•mol -1;
(2)①根据4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,可知12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,故答案为:72.6;
②根据(H-O)-(H-N)=72.6kJ/mol,可知H-O 键比H-N键强,
故答案为:强;
(3)①图中b点,氨气的体积分数逐渐增加,可知向正反应方向移动,正反应速率大于逆反应速率,
故答案为:>;
②图中a点,设反应的N2为x,
N2+3H2?2NH3
初始物质的量:1 3 0
变化的物质的量:x 3x 2x
平衡时的物质的量:1-x 3-3x 2x
氨气的体积分数为50%时,则$\frac{2x}{1-x+3-3x+2x}$=50%,
解之得x=$\frac{2}{3}$,
则n(N2):n(NH3)=$\frac{1}{3}$:$\frac{4}{3}$=1:4,
故答案为:1:4;
(4)水中的氧气氧化氨气生成亚硝酸和水,方程式为2NH3+3O2═2HNO2+2H2O,
故答案为:2NH3+3O2═2HNO2+2H2O;
(5)电解法能将碱性溶液中的NO2-转化为N2和OH-,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-,
故答案为:2NO2-+6e-+4H2O=N2↑+8OH-.
点评 本题是一道有关氮元素的综合题,考查学生分析和解决问题的能力,主要是热化学方程式书写、题目难度中等.

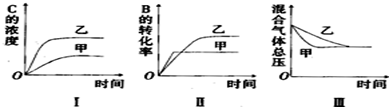
下列判断正确的是( )
| A. | 图I研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的可能是压强对反应的影响,且甲的压强较高 | |
| C. | 图Ⅱ研究的可能是温度对反应的影响,且甲的温度较高 | |
| D. | 图Ⅲ研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| A. | 漂白粉在溶液中存在平衡:ClO-+H2O?HClO+OH-,加少量NaOH能提高其漂白效率 | |
| B. | 硫酸钡难溶子水,但硫酸钡属于强电解质 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 物质的量浓度相同的四种溶液:①氯化铵②硫酸氢铵 ③次氯酸铵④碳酸铵的pH:④>②>①>③ |
| A. | 1 mol | B. | 0.5 mol | C. | 0.75 mol | D. | 0.25 mol |
| A. | 化学反应中,物质变化的同时不一定发生能量变化 | |
| B. | 反应焓变(△H)的大小与方程式中各物质的化学计量系数无关 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 吸热反应中,形成化学键释放的能量大于断裂化学键吸收的能量 |
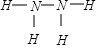 ,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.
,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.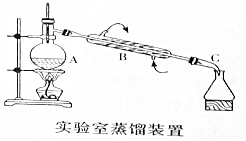 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.