题目内容
1.现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B、49g C,还有D生成.已知D的相对分子质量为106.现将80g A和33g B反应,能生成D( )| A. | 1 mol | B. | 0.5 mol | C. | 0.75 mol | D. | 0.25 mol |
分析 40gA完全反应,参加反应的B的质量为40g-18g=22g,生成的C的质量为49g-40g=9g,根据质量守恒定律计算生成的D的质量,根据质量定比定律计算80gA和33gB反应,哪种物质有剩余,根据不足量的物质利用质量定比关系计算生成D的质量,再n=$\frac{m}{M}$计算D的物质的量.
解答 解:40gA完全反应,参加反应的B的质量为40g-18g=22g,生成的C的质量为49g-40g=9g,根据质量守恒定律可知生成的D的质量为40+22-9=53g,
33gB反应需要A的质量为33g×$\frac{40}{22}$=60g,则A过量,
B完全反应生成D的质量为33g×$\frac{53}{22}$=79.5g,
D的相对分子质量为106,则D的物质的量为$\frac{79.5g}{106g/mol}$=0.75mol,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握质量守恒定量及过量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
16.ICl3遇水会产生大量的腐蚀性白色浓雾,有强烈的催泪性.若两种生成物之一是HCl,则另一种是( )
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
6.已知某饱和溶液中①溶质的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
13.2mol O2和3mol O2的质量之比( )
| A. | 2:3 | B. | 2:1 | C. | 1:1 | D. | 4:3 |
10.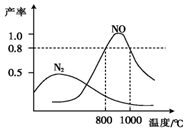 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
11.对于溶液中某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液无明显现象,再加入新制氯水溶液变为血红色,一定有Fe2+ | |
| D. | 加入过量硝酸银溶液,产生白色沉淀,再加入稀盐酸沉淀不溶解,则一定含有C1- |
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用. 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+ $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+