题目内容
14.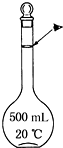 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:①用托盘天平称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
②把①所得溶液小心转入500mL容量瓶中.
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑤将容量瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为①②④③⑤(填序号).
(2)实验步骤空白处涉及到的实验仪器
①托盘天平②500mL容量瓶③胶头滴管④烧杯和玻璃棒.
(3)某同学观察液面的情况如图所示,所配溶液浓度偏高(填“偏高”“偏低”或“无影响”).
(4)若出现如下情况,对所配溶液浓度将有何影响?
没有进行操作步骤④偏低;加蒸馏水时不慎超过了刻度偏低.(填“偏高”“偏低”或“无影响”)
分析 (1)根据配制500mL 0.5mol/L的NaCl溶液的步骤对各操作进行排序;
(2)①称量固体药品用托盘天平;②根据配制的溶液体积选用容量瓶的规格;③定容时先直接加水定容,最后需要改用胶头滴管定容;④溶解氯化钠的玻璃仪器上粘有溶质需洗涤;
(3)定容时俯视刻度线,导致所配溶液的液体偏小,浓度偏高;
(4)没有洗涤烧杯和玻璃棒,会导致配制的溶液中溶质的物质的量偏小;加水超过容量瓶刻度线,会导致配制的溶液浓度偏低.
解答 解:(1)配制500mL 0.5mol/L的NaCl溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的配制顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)称量氯化钠固体需用托盘天平;
配制500mL溶液时需要使用500mL容量瓶,将溶解后的溶液转移到500mL容量瓶中;
定容的正确方法为:先直接向容量瓶中加蒸馏水至液面距刻度标线2-3cm处,然后改用胶头滴管进行定容;
溶解氯化钠的玻璃仪器烧杯和玻璃棒上粘有溶质需洗涤,否则配制的溶液浓度偏低;
故答案为:托盘天平;500mL容量瓶;胶头滴管;烧杯和玻璃棒;
(3)定容时俯视刻度线,导致所配溶液的液体偏小,浓度偏高,
故答案为:偏高;
(4)如果没有洗涤烧杯和玻璃棒,配制的溶液中溶质氯化钠的物质的量偏小,配制的溶液浓度偏低;
定容时如果加水超过容量瓶刻度线,会导致配制的溶液体积偏大,配制的溶液浓度偏低,
故答案为:偏低;偏低.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液方法,明确误差分析的方法与技巧.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.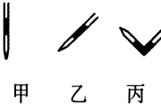 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、烧杯(或表面皿)、药匙.
(2)取20.00mL待测盐酸放人锥形瓶中,并滴加2〜3滴酚酞作指示剂,用自己配制的NaOH 标准溶液进行滴定.重复上述滴定操作2〜3 次,记录数据如下.
①滴定达到终点的标志是最后加入一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内浅红色不褪去.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排除碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D.
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
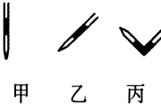 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:(1)配制100mL 0.10mol•L-1 NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、烧杯(或表面皿)、药匙.
(2)取20.00mL待测盐酸放人锥形瓶中,并滴加2〜3滴酚酞作指示剂,用自己配制的NaOH 标准溶液进行滴定.重复上述滴定操作2〜3 次,记录数据如下.
实验编号 | NaOH溶液的浓度/(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排除碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D.
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
20.下列说法正确的是( )
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |




 昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质
COS(g)+H2(g) K=0.1反应前CO物质 的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是