题目内容
15.某小组同学要配制85mL 0.1mol•L-1 Na2CO3溶液.下图是一些关键步骤和操作.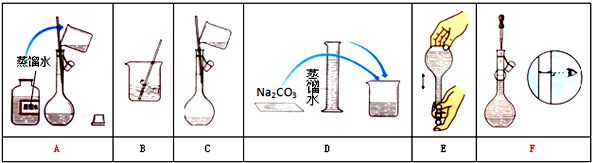
(1)配制过程的先后顺序为(用字母A~F填写)DBCAFE.
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、100ml容量瓶、胶头滴管.
(3)容量瓶上需标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式A
A.①③⑤B.③⑤⑥C.①②④D.②④⑥
(4)若用Na2CO3•10H2O晶体来配制溶液,需用托盘天平称量固体2.9g.
(5)在步骤B之后,需冷却至室温才进行下一步操作.
(6)下列操作使配得的溶液浓度偏低的是②③⑥⑦
①Na2CO3•10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶用蒸馏水洗涤后未经干燥就使用 ⑥转移过程中没有洗涤烧杯
⑦定容时仰视刻度线.
分析 (1)根据配制一定物质的量浓度的溶液的正确操作方法对图示操作过程进行排序;
(2)根据配制一定物质的量浓度的溶液使用的仪器进行解答;
(3)根据容量瓶的使用方法分析,容量瓶是用来配制一定物质的量浓度溶液的定量容器,只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器;
(4)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(5)碳酸钠晶体在溶解过程中会放出热量,需要冷却至室温后才能转移到容量瓶中.
(6)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
解答 解:(1)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确的顺序为:DBCAFE,
故答案为:DBCAFE;
(2)配制100mL 0.100mol•L-1 Na2CO3溶液需要使用的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管和100mL容量瓶,所以还缺少100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶 胶头滴管;
(3)容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量容器,容量瓶上标有容量、刻度线,则③⑤正确;容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器,则①正确;与浓度、压强、酸式或碱式无关,①③⑤正确,
故选:A;
(4)实验室需要0.1mol/L的Na2CO3溶液85mL,由于容量瓶的规格没有85mL,只能用100mL容量瓶,则100mLNa2CO3溶液需要Na2CO3的物质的量为:0.1L×0.1mol/L=0.01mol,Na2CO3•10H2O的物质的量为0.01mol,Na2CO3•10H2O的质量为:0.01mol×286g/mol=2.86g,托盘天平只能称准到0.1g,故应该称2.9g固体,
故答案为:2.9g;
(5)碳酸钠晶体在溶解时会放出热量,温度会影响溶液的体积,所以必须待溶液冷却至室温后再转移到容量瓶中,否则会影响配制结果,
故答案为:冷却至室温.
(6)碳酸钠晶体失去了部分结晶水,溶质的质量偏大,溶质的物质的量偏大,则配制溶液浓度偏高;
②用“左码右物”的称量方法称量晶体,溶质的质量偏低,溶质的物质的量偏低,则配制溶液浓度偏低;
③碳酸钠晶体不纯,其中混有氯化钠,溶质的质量偏低,溶质的物质的量偏低,则配制溶液浓度偏低;
④称量碳酸钠晶体时所用砝码生锈,溶质的质量偏大,溶质的物质的量偏大,则配制溶液浓度偏高;
⑤容量瓶未经干燥就使用,溶质的物质的量和溶液的体积都不改变,所以配制溶液浓度不变;
⑥转移过程中没有洗涤烧杯,造成溶质损失,浓度偏低;
⑦定容时仰视刻度线,水加多了,浓度偏低.
故答案为:②③⑥⑦;
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度不大,注意掌握正确的配制方法,本题中误差分析为难度,注意明确误差分析的方法及技巧.

| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| A. | 2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA | |
| B. | 32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| C. | 物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA | |
| D. | 1molD3${\;}_{\;}^{18}$O+(其中D代表${\;}_{1}^{2}$H)中含有的中子数为10NA |
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
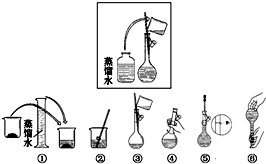 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.