题目内容
1.氢氧化铝在水中可建立如下平衡:Al3++3OH-?Al(OH)3?H++AlO2-+H2O,运用勒夏特列原理判断,下列叙述中正确的是( )| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
分析 A.加NaOH会消耗氢离子,平衡右移;
B.加浓盐酸会消耗氢氧根离子;
C.Al3+与OH-会生成Al(OH)3;
D.AlO2-与H+能生成Al(OH)3.
解答 解:A.加NaOH会消耗氢离子,平衡右移,Al(OH)3的质量减少,故A错误;
B.加浓盐酸会消耗氢氧根离子,平衡左移,Al3+的物质的量增加,故B正确;
C.Al3+与OH-会生成Al(OH)3沉淀,所以在同一溶液中,Al3+与OH-不能大量共存,故C错误;
D.AlO2-与H+能生成Al(OH)3沉淀,所以在同一溶液中,AlO2-与H+不能大量共存,故D错误.
故选B.
点评 本题考查了铝的化合物的性质、化学平衡移动原理的应用,题目难度不大,注意把握浓度对化学平衡的影响.

练习册系列答案
相关题目
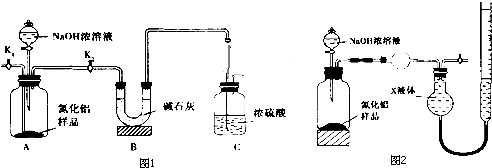
11.电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
(4)完成步骤IV需要用到的实验装置是ab(填字母).
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |

12.下列说法不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③H2SO4固态不导电,液态可以导电
④A12O3固态不导电,熔融态也不导电.
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③H2SO4固态不导电,液态可以导电
④A12O3固态不导电,熔融态也不导电.
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
9.下列有关胶体的说法不正确的是( )
| A. | 向Al(OH )3胶体中加入酒精溶液能发生聚沉现象 | |
| B. | 豆浆和雾都是胶体 | |
| C. | Fe(OH )3 胶体能透过滤纸 | |
| D. | 向沸水中加入饱和的FeCl3溶液,可制备Fe(OH )3 胶体 |
6.青蒿素(分子式为C15H22O5)是从植物黄花蒿叶中提取的可用于治疗疟疾的药物.我国科学家屠呦呦因在青蒿素及双氢青蒿素(分子式为C15H24O5)领域的开创性研究分享了2015诺贝尔生理学及医学奖,成为了首位获得诺贝尔奖的中国本土科学家.青蒿素为无色针状晶体,味苦.在乙醚中可溶解,在水中几乎不溶.下列说法正确的是( )
| A. | 青蒿素的摩尔质量为282g | |
| B. | 青蒿素的化学合成方法没有任何研究意义 | |
| C. | 青蒿素转化为双氢青蒿素是物理变化 | |
| D. | 用乙醚提取黄花蒿叶中的青蒿素比用水效果好 |
13.下列排序不正确的是( )
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:H3PO4<H2SO4<HClO4 | |
| C. | 最高正化合价:氯>硫>磷 | |
| D. | 热稳定性:碘化氢>溴化氢>氯化氢 |
11.下列实验装置设计正确,且能达到目的是( )
| A. |  测定乙醇分子结构 | B. | 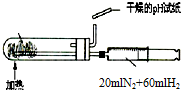 合成氨并检验氨的生成 | ||
| C. | 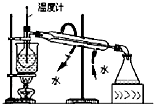 碘的CCl4溶液中分离I2 | D. | 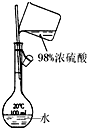 配制稀硫酸溶液 |