题目内容
6.麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图:
①麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
②下列各物质:

与麻黄素互为同分异构体的是D(填序号,下同),C互为同系物.
分析 (1)根据麻黄素的结构简式判断其分子中含有的官能团名称;
(2)先判断麻黄素的分子式及含有的官能团类型,然后结合同分异构体和同系物的定义进行判断.
解答 解:(1)麻黄素中含氧官能团为羟基,可看成醇类物质,
故答案为:羟基;醇;
(2)麻黄素的分子式为:C10H15NO,分子式相同而结构不同的有机物互称同分异构体,题中D与麻黄素的分子式相同、结构不同,它们互为同分异构体;
C 与麻黄素的结构相似,分子间相差1个CH2原子团,二者互为同系物,
与麻黄素的结构相似,分子间相差1个CH2原子团,二者互为同系物,
故答案为:D;C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握同分异构体和同系物的定义以及判断,难度不大,答题时注意规范性,如(1)要求书写名称,不能写成结构简式.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
1.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中:Na+、ClO-、SO42-、I- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
17.下列物质的分子中,只由σ键形成的是( )
| A. | 氮气 | B. | 甲烷 | C. | 乙烯 | D. | 乙炔 |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1 mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2 molN2和0.3 molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
11.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、Na+、NO${\;}_{3}^{-}$、OH- | B. | NH${\;}_{4}^{+}$、Fe3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | SO${\;}_{4}^{2-}$、Cl-、Ba2+、Mg2+ | D. | H+、K+、CO${\;}_{3}^{2-}$、Cl- |
15.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图:

已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物A中的成分是SiO2、Cu.
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=Cu2++2Fe2+.
(3)x、y对应的数值范围分别是3.2≤pH<4.0、5.2≤pH<5.4.
(4)电解法获取Cu时,阴极反应式为Cu2++2e-=Cu,阳极反应式为2Cl--2e-=Cl2↑.
(5)下列关于NaClO调pH的说法正确的是b.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+═HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O═HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO.
16.元素Y的原子获得3个电子或元素X失去2个电子后,它们的电子层结构与氖原子的相同,X、Y两元素形成的化合物的正确的化学式是( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y2 | D. | Y2X3 |
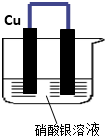 如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.
如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.