题目内容
 运用化学反应原理研究碳的化合物具有重要意义.
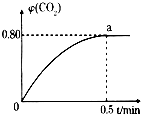
运用化学反应原理研究碳的化合物具有重要意义.(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(g)?5CO2(g)+I2(s)△H<0.向2L密闭容器中加入足量I2O5(s),并通人1mol CO,CO2的体积分数φ(CO2)随时间的变化如图所示.
①0~0.5min内的平均反应速率v(CO)=
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数φ(CO2),可采取的措施为
(2)以Cu2Al2O4为催化剂,可以将COx和CH4的混合气体直接转化为乙酸.
①若该反应的原子利用率为100%,则COx中x=
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b
(3)利用反应2NO2+4CO═N2+4CO2可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为
考点:产物的百分含量随浓度、时间的变化曲线,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:(1)①列三段式求出0~0.5min内反应消耗的CO,再求出其反应速率;
②该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,根据等效平衡的特点分析;
③欲增大容器中CO2的体积分数φ(CO2),则平衡正移,根据影响平衡的因素分析;
(2)①根据原子守恒计算;
②pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此分析;醋酸的电离常数K=
,c(醋酸)=c(NaOH),氢离子浓度已知,则可以计算出K;
(3)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应.
②该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,根据等效平衡的特点分析;
③欲增大容器中CO2的体积分数φ(CO2),则平衡正移,根据影响平衡的因素分析;
(2)①根据原子守恒计算;
②pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此分析;醋酸的电离常数K=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
(3)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应.
解答:
解:(1)①设0~0.5min内反应消耗的CO为xmol,
5CO(g)+I2O5(g)?5CO2(g)+I2(s)
起始量(mol):1 0
反应量(mol):x x
平衡量(mol):1-x x
则
=0.8,所以x=0.8,则v(CO)=
=
=0.8mol/(mol?L);
故答案为:0.8mol/(mol?L);
②该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,
a.等效平衡的转化率相同,若开始加入CO(g)的物质的量是原来的2倍,则生成I2的质量为原来的2倍,故a正确;
b.该反应反应前后气体的物质的量相同,当开始加入CO(g)的物质的量是原来的2倍,达到平衡时,气体的物质的量增大2倍,质量也增大2倍,所以混合气体的平均摩尔质量不变,故b正确;
c.反应物的浓度增大,反应速率加快,所以达到平衡的时间比原来的2倍小,故c错误;
d.混合气体的体积不变,气体的质量增大,所以气体的密度增大,故d错误;
故答案为:ab;
③欲增大容器中CO2的体积分数φ(CO2),则平衡正移,已知该反应正方向为放热反应,所以降低温度平衡正移;
故答案为:降低温度;
(2)①将COx和CH4的混合气体直接转化为乙酸,则反应方程式为:COx+CH4=C2H4O2,根据O原子守恒得x=2;
故答案为:2;
②pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,
醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,
酸碱恰好中和,则酸的物质的量与碱的物质的量相等,则c(NaOH)=c(OH-)=10a-14mol/L=c(醋酸)>10-bmol/L,
所以10a-14>10-b,则a+b>14;
c(醋酸)=c(NaOH)=10a-14mol/L,c(H+)=c(CH3COO-)=10-bmol/L,则醋酸的电离常数K=
=
=
;
故答案为:a+b>14;
;
(3)利用反应2NO2+4CO═N2+4CO2可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,负极上CO失电子发生氧化反应,正极上NO2得电子发生还原反应生成N2,其正极电极反应式为:2NO2+8e-=N2+4O2-;
故答案为:2NO2+8e-=N2+4O2-.
5CO(g)+I2O5(g)?5CO2(g)+I2(s)
起始量(mol):1 0
反应量(mol):x x
平衡量(mol):1-x x
则
| xmol |
| 1mol |
| ||
| t |
| ||
| 5min |
故答案为:0.8mol/(mol?L);
②该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,
a.等效平衡的转化率相同,若开始加入CO(g)的物质的量是原来的2倍,则生成I2的质量为原来的2倍,故a正确;
b.该反应反应前后气体的物质的量相同,当开始加入CO(g)的物质的量是原来的2倍,达到平衡时,气体的物质的量增大2倍,质量也增大2倍,所以混合气体的平均摩尔质量不变,故b正确;
c.反应物的浓度增大,反应速率加快,所以达到平衡的时间比原来的2倍小,故c错误;
d.混合气体的体积不变,气体的质量增大,所以气体的密度增大,故d错误;
故答案为:ab;
③欲增大容器中CO2的体积分数φ(CO2),则平衡正移,已知该反应正方向为放热反应,所以降低温度平衡正移;
故答案为:降低温度;
(2)①将COx和CH4的混合气体直接转化为乙酸,则反应方程式为:COx+CH4=C2H4O2,根据O原子守恒得x=2;
故答案为:2;
②pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,
醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,
酸碱恰好中和,则酸的物质的量与碱的物质的量相等,则c(NaOH)=c(OH-)=10a-14mol/L=c(醋酸)>10-bmol/L,
所以10a-14>10-b,则a+b>14;
c(醋酸)=c(NaOH)=10a-14mol/L,c(H+)=c(CH3COO-)=10-bmol/L,则醋酸的电离常数K=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 10-b×10-b |
| 10a-14-10-b |
| 10-2b |
| 10a-14-10-b |
故答案为:a+b>14;
| 10-2b |
| 10a-14-10-b |
(3)利用反应2NO2+4CO═N2+4CO2可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,负极上CO失电子发生氧化反应,正极上NO2得电子发生还原反应生成N2,其正极电极反应式为:2NO2+8e-=N2+4O2-;
故答案为:2NO2+8e-=N2+4O2-.
点评:本题考查了化学平衡的有关计算、影响平衡的因素、酸碱混合溶液的有关计算、原电池原理的应用等,题目综合性较强,难度较大,侧重于考查学生对知识的综合应用能力和数据处理能力.

练习册系列答案
相关题目
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
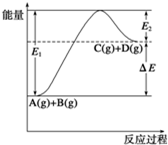

| A、1mol A与1mol B充分反应后,能量变化为△E |
| B、加入催化剂后,反应加快,△E减小 |
| C、反应物的总键能小于生成物的总键能 |
| D、反应达到平衡时,升高温度,A的转化率增大 |
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
| A、2011年3月11日,日本发生大地震,并引发核电厂爆炸,核反应属于物理变化 |
| B、“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关 |
| C、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
常温下,某酸性溶液中只含有NH4+、Cl-、H+、OH-4种离子,下列说法不正确的是( )
| A、可由pH=3的HCl与pH=11的NH3?H2O溶液等体积混合而成 |
| B、该溶液中离子间一定满足:c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| C、加入适量NH3?H2O,溶液中离子浓度可能为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、该溶液可能由等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合而成 |
下列试剂的保存不正确的是( )
| A、漂白粉必须密封保存 |
| B、新制的氯水用棕色瓶保存 |
| C、镁条要密封保存 |
| D、固体钠保存在煤油中 |
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示: 镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: