题目内容
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:(1)若该交换膜为阳离子交换膜(只允许阳离子自由通过).左边充满加过盐酸酸化的H2O2溶液.右边充满滴有少量KSCN溶液的FeCl2溶液(FeCl2过量),一段时间后可观察到的现象:右边
A.无明显现象 B.溶液有浅绿色变红色 C.溶液由无色变黄色 D.盐溶液由浅绿色变无色
试写出左边发生的离子方程式
(2)若该交换膜为阴离子交换膜(只允许阴离子自由通过).左边充满1mol?L-1的NaHCO3溶液,右边充满等体积的1mol?L-1的NaAlO2溶液,一段时间后可观察到的现象:左边
A.无明显现象 B.有气泡产生 C.有白色胶状沉淀生成 D.有红褐色沉淀生成
试比较最终容器内所得溶液中离子浓度的大小
考点:铁盐和亚铁盐的相互转变,镁、铝的重要化合物
专题:元素及其化合物
分析:(1)交换膜为阳离子交换膜,二价铁离子通过交换膜从右边进入到左边被双氧水氧化生成三价铁离子,三价铁离子通过交换膜与硫氰根离子反应生成血红色的络合物;
(2)NaHCO3溶液中碳酸氢根离子是多元弱酸的酸式根离子,水解生成碳酸和氢氧化钠,交换膜为阴离子交换膜,NaAlO2 电离出的AlO2 -通过交换膜与水解生成的碳酸反应生成氢氧化铝沉淀;
(3)碳酸氢钠和偏铝酸钠都是强电解质,完全电离产生碳酸氢根离子、偏铝酸根离子和钠离子,碳酸氢根离子水解生成碳酸,与偏铝酸根离子发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 ,反应后溶液主要溶质为碳酸钠,据此判断各种离子浓度大小.
(2)NaHCO3溶液中碳酸氢根离子是多元弱酸的酸式根离子,水解生成碳酸和氢氧化钠,交换膜为阴离子交换膜,NaAlO2 电离出的AlO2 -通过交换膜与水解生成的碳酸反应生成氢氧化铝沉淀;
(3)碳酸氢钠和偏铝酸钠都是强电解质,完全电离产生碳酸氢根离子、偏铝酸根离子和钠离子,碳酸氢根离子水解生成碳酸,与偏铝酸根离子发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 ,反应后溶液主要溶质为碳酸钠,据此判断各种离子浓度大小.
解答:
解:(1)二价铁离子通过交换膜从右边进入到左边被双氧水氧化生成三价铁离子,三价铁离子通过交换膜与硫氰根离子反应生成血红色的络合物,发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:B;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)NaHCO3溶液中碳酸氢根离子是多元弱酸的酸式根离子,水解生成碳酸和氢氧化钠,交换膜为阴离子交换膜,NaAlO2 电离出的AlO2 -通过交换膜与水解生成的碳酸反应生成氢氧化铝沉淀,所以左边会看到有白色胶状沉淀产生,
故答案为:C;
(3)碳酸氢钠和偏铝酸钠都是强电解质,完全电离产生碳酸氢根离子、偏铝酸根离子和钠离子,碳酸氢根离子水解生成碳酸,与偏铝酸根离子发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 ,反应后溶液主要溶质为碳酸钠,所以最终容器内所得溶液中离子浓度的大小顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
故答案为:B;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)NaHCO3溶液中碳酸氢根离子是多元弱酸的酸式根离子,水解生成碳酸和氢氧化钠,交换膜为阴离子交换膜,NaAlO2 电离出的AlO2 -通过交换膜与水解生成的碳酸反应生成氢氧化铝沉淀,所以左边会看到有白色胶状沉淀产生,
故答案为:C;
(3)碳酸氢钠和偏铝酸钠都是强电解质,完全电离产生碳酸氢根离子、偏铝酸根离子和钠离子,碳酸氢根离子水解生成碳酸,与偏铝酸根离子发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 ,反应后溶液主要溶质为碳酸钠,所以最终容器内所得溶液中离子浓度的大小顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评:本题考查了铁及其化合物的转化,碳酸氢钠与偏铝酸钠的性质,题目难度中等,解题关键在于明确离子交换膜的作用.

练习册系列答案
相关题目
下列化合物中,苯环上的氢原子被溴原子取代,所得一溴代物有三种同分异构体的是( )

| A、①③ | B、①④ | C、②③ | D、③④ |
现有三组分散系:①CCl4和NaCl的混合液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合溶液(苯和甲苯是性质非常相似的一对互溶液体);③掺有碘化钾的碘水,分离以上各混合液的正确方法依次是( )
| A、分液、蒸馏、萃取 |
| B、萃取、蒸馏、分液 |
| C、蒸馏、萃取、分液 |
| D、分液、萃取、蒸馏 |
下列名词与环境污染无关的是( )
| A、酸雨 | B、光化学烟雾 |
| C、冻雨 | D、水体富营养化 |
下列各组物质中,化学键类型完全相同的是( )
| A、HI和NaI |
| B、H2S和CO2 |
| C、H2O和NH4Cl |
| D、F2和NaBr |
下列说法正确的是( )
| A、一些有机溶剂(如乙醚、乙醇、苯、丙酮等)极易被引燃,使用时必须远离明火和热源用毕立即塞紧瓶塞 |
| B、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| C、减压过滤洗涤沉淀时,应先关闭水龙头,在布氏漏斗上加上洗涤剂,然后开大水龙头,使洗涤剂快速通过沉淀物 |
| D、酚醛树脂制备实验完毕后应及时清洗试管,如果不易洗涤,可以加入少量盐酸,浸泡几分钟,然后清洗 |
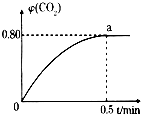 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义. 有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.
有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.