题目内容
 镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:反应I Ni(s)+4CO(g)
| 350℃ |
反应II Ni(CO)4(g)
| 470℃ |
反应I和反应Ⅱ分别在连通的A装置和B装置中同时进行,A、B容积之和为2L.
(1)在温度不变的情况下,要提高反应I中Ni(CO)4的产率,可采取的措施有
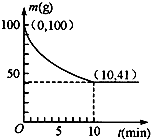
(2)350K时,在装置A中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入4mol CO气体制备Ni(CO)4,装置A中剩余固体质量和反应时间的关系如图所示.
①若10min达到平衡时得到29.5g纯镍,则反应I的平衡常数K1为
②0~10min的平均反应速率υ[Ni(CO)4]=
(3)反应Ⅱ中△H2
a.平衡常数K2增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池.电池充放电时的总反应为:NiO(OH)+MH
| 放电 |
| 充电 |
考点:化学平衡常数的含义,化学电源新型电池,化学平衡建立的过程,化学平衡的影响因素,化学平衡的调控作用,物质的量或浓度随时间的变化曲线
专题:化学平衡专题,电化学专题
分析:(1)若温度不变,结合反应I为气体体积缩小的反应及改变气体的浓度时平衡正向移动提高Ni(CO)4的产率;
(2)1-10min内粗镍质量减少100g-41g=59g,杂质不反应,则镍的质量为59g,依据化学方程式计算反应的Ni,由物质的量得到变化浓度,结合v=
、K=
计算;
(3)由反应I为放热反应可知,反应II为吸热反应,因此反应II达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小;
(4)电池充电时,阳极上Ni(OH)2失去电子,发生氧化反应,而阴极上发生还原反应.
(2)1-10min内粗镍质量减少100g-41g=59g,杂质不反应,则镍的质量为59g,依据化学方程式计算反应的Ni,由物质的量得到变化浓度,结合v=
| △c |
| △t |
| c[Ni(CO)4] |
| c4(CO) |
(3)由反应I为放热反应可知,反应II为吸热反应,因此反应II达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小;
(4)电池充电时,阳极上Ni(OH)2失去电子,发生氧化反应,而阴极上发生还原反应.
解答:
解:(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、增大CO的浓度、从反应体系中移走Ni(CO)4(g)等措施均可使反应正向进行,提高Ni(CO)4的产率,
故答案为:增大压强;增大CO浓度;
(2)随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g,因杂质不反应,则I中反应的镍的质量为59g,反应纯Ni的物质的量
=1mol,10min生成纯Ni29.5g,其物质的量为
=0.5mol,则
反应I Ni(s)+4CO(g)
Ni(CO)4(g)
开始 1 4 0
转化 x 4x x
反应II Ni(CO)4(g)
Ni(s)+4CO(g)
开始 x
转化 0.5 0.5 2
平衡 0.5 0.5 2
(可简化为Ni(s)+4CO(g)
Ni(CO)4(g)
开始 1 4 0
转化 0.5 2 0.5
平衡 0.5 2 0.5
①若10min达到平衡时,平衡时c(CO)=
=1mol/L,c[Ni(CO)4]=
=0.25mol/L,则反应I的平衡常数K1为
=0.25,故答案为:0.25;
②实际参加反应的Ni为0.5mol,则0~10min的平均反应速率υ[Ni(CO)4]=
=0.025mol/(L.min),故答案为:0.025mol/(L.min);
(3)两个反应过程相反,物质的化学计量数不变,由由反应I为放热反应可知,反应II为吸热反应,即△H2>0,降温,平衡逆向进行,
a、温度降低平衡向放热反应方向进行,反应II是吸热反应,平衡逆向进行,平衡常数减小,故错误;
b、温度降低平衡向放热反应方向进行,反应II是吸热反应,平衡逆向进行一氧化碳浓度减小,故正确;
c、依据反应分析,温度降低反应I平衡正向进行,反应II逆向进行,镍质量减小,故正确;
d、平衡逆向进行,温度降低,v逆[Ni(CO)4]减小,故错误;
故答案为:>;bc;
(4)由电池充放电时的总反应为:NiO(OH)+MH
Ni(OH)2+M,放电时NiO(OH)作为电池正极材料,MH为负极材料,则充电时阳极与正极相连,则电池充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O,为氧化反应,所以阴极上得到电子发生还原反应,电极反应为:M+H2O+e-=MH+OH-,
故答案为:Ni(OH)2+OH--e-=NiO(OH)+H2O;还原.
故答案为:增大压强;增大CO浓度;
(2)随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g,因杂质不反应,则I中反应的镍的质量为59g,反应纯Ni的物质的量
| 59g |
| 59g/mol |
| 29.5g |
| 59g/mol |
反应I Ni(s)+4CO(g)
| 350℃ |
开始 1 4 0
转化 x 4x x
反应II Ni(CO)4(g)
| 470℃ |
开始 x
转化 0.5 0.5 2
平衡 0.5 0.5 2
(可简化为Ni(s)+4CO(g)
| 350℃ |
开始 1 4 0
转化 0.5 2 0.5
平衡 0.5 2 0.5
①若10min达到平衡时,平衡时c(CO)=
| 2mol |
| 2L |
| 0.5mol |
| 2L |
| 0.25 |
| 14 |
②实际参加反应的Ni为0.5mol,则0~10min的平均反应速率υ[Ni(CO)4]=
| ||
| 10min |
(3)两个反应过程相反,物质的化学计量数不变,由由反应I为放热反应可知,反应II为吸热反应,即△H2>0,降温,平衡逆向进行,
a、温度降低平衡向放热反应方向进行,反应II是吸热反应,平衡逆向进行,平衡常数减小,故错误;
b、温度降低平衡向放热反应方向进行,反应II是吸热反应,平衡逆向进行一氧化碳浓度减小,故正确;
c、依据反应分析,温度降低反应I平衡正向进行,反应II逆向进行,镍质量减小,故正确;
d、平衡逆向进行,温度降低,v逆[Ni(CO)4]减小,故错误;
故答案为:>;bc;
(4)由电池充放电时的总反应为:NiO(OH)+MH
| 放电 |
| 充电 |
故答案为:Ni(OH)2+OH--e-=NiO(OH)+H2O;还原.
点评:本题考查化学平衡常数的含有及物质含量随时间的变化曲线等,综合性较强,侧重高频考点的考查,还涉及化学平衡计算、平衡常数计算、反应速率计算及电化学知识等,较好的体现学生分析能力、计算能力及综合应用知识的能力,题目难度较大,(2)为解答的难点和易错点.

练习册系列答案
相关题目
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+9072kJ?K=1.1×1026?
②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g)+1105kJ?K=4.4×1028
③4NH3(g)+3O2(g)?2N2(g)+6H2O(g)+1269kJ?K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是 ( )
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+9072kJ?K=1.1×1026?
②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g)+1105kJ?K=4.4×1028
③4NH3(g)+3O2(g)?2N2(g)+6H2O(g)+1269kJ?K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是 ( )
| A、减小压强 |
| B、降低温度 |
| C、增大O2浓度 |
| D、使用合适的催化剂 |
我国发射载人航天飞船用于火箭起动炸药的是氕化锂、氘化锂和氚化锂,它们( )
| A、都是共价化合物 |
| B、都具有较强还原性 |
| C、由同位素原子构成的同分异构体 |
| D、微粒的半径H-小于Li+ |
氯气性质很活泼,它具有较强的氧化性,下列叙述中不正确的是( )
| A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B、因为氯气能和Fe反应,所以液氯不能装在干燥的钢瓶里 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合发生爆炸 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义. Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子
Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子