题目内容
19.工业上,若输送Cl2的管道漏气,用NH3进行检验时生成NH4Cl和N2.下列说法正确的是( )| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H两种核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半径:r(Cl)>r(Cl-) | |
| C. | 工业上常用干燥的钢瓶储存液氯,是因为铁和氯气在任何条件下都不反应 | |
| D. | 该反应表明常温下氯气有氧化性 |
分析 A.依据氢元素的三种同位素解答;
B.质子数相同,电子数越多,半径越大;
C.铁与氯气高温下反应生成氯化铁;
D.依据反应中氯元素化合价变化判断氯气的性质.
解答 解:A.元素H只有${\;}_1^1$H和${\;}_1^2$H、13H三种核素,故A错误;
B.氯原子与氯离子具有相同的质子数,氯离子电子数多元氯原子所以
C.铁与氯气高温下反应生成氯化铁,故C错误;
D.氯气与氨气反应生成氮气、氯化铵,反应中氯元素化合价降低,所以氯气为氧化剂,表现氧化性,故D正确;
故选:D.
点评 本题为综合题,涉及常见元素的同位素、微粒半径大小比较、氯气、氨气的性质,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
10.下列实验操作可以达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 配制银氨溶液 | 向3mL2%的AgNO3溶液中滴入2滴2%的氨水 |
| B | 分离提纯鸡蛋清中的蛋白质 | 向鸡蛋清溶液中加入醋酸铅溶液,充分振荡后过滤,将不溶物加入蒸馏水中 |
| C | 检验蔗糖水解溶液的还原性 | 取2mL 20%的蔗糖溶液,加入少量稀硫酸,水浴后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| D | 检验溴乙烷在NaOH溶液中是否发生水解 | 将溴乙烷与NaOH溶液共热.冷却后,取出上层溶液,用稀硝酸酸化,加入AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 24克金刚石中含有的碳碳键数目为4NA | |
| B. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 1L1mol•L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA | |
| D. | 120克熔融的NaHSO4中含有的离子数为3NA |
4.下列指定反应的离子方程式正确的是( )
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
10.下列说法不正确的是( )
| A. | CH3CH2CH3与CH4互为同系物 | |
| B. | 乙醇和乙酸都能与金属钠反应 | |
| C. | 正丁烷(CH3CH2CH2CH3)与异丁烷(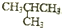 )互为同分异构体 )互为同分异构体 | |
| D. | 甲烷与苯在空气中燃烧的现象相同 |
11.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是a、c、e(填字母代号).
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②温度升高,该反应的平衡常数K减小(填“增大”、“减小”或“不变”)
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是a、c、e(填字母代号).
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②温度升高,该反应的平衡常数K减小(填“增大”、“减小”或“不变”)

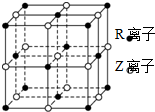 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.