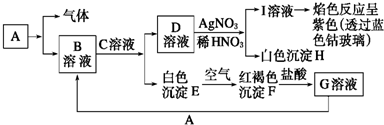
题目内容
1. 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1
NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1
反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-86.98 kJ•mol-1.
②液氨可以发生电离:2NH3(l)?NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式COCl2+4NH3═CO(NH2)2+2NH4Cl.
(2)氨气易液化,便于储运,可利用NH3作储氢材料
已知:2NH3(g)?N2(g)+3H2(g)△H=+92.4kJ•mol-1
①氨气自发分解的反应条件是高温(填“低温”或“高温”).
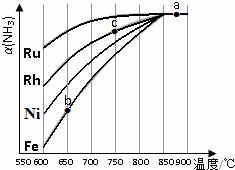
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是Ru(填催化剂的化学式).c点氨气的转化率高于b点,原因是b、c点均未到达平衡,c点温度高,且Ru比Fe的催化能力强,反应速率越快,氨气的转化率越高.
分析 (1)①已知:Ⅰ.2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g);
②液氨可以发生电离:2NH3(l)?NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,还生成NH4Cl;
(2)①△H-T△S<0反应自发进行;
②相同温度下,氨气转化率越大,说明反应速率越快,催化剂的催化效果越好;
b、c点均未到达平衡,温度越高、催化剂能力越强,反应速率越快,氨气的转化率越高.
解答 解:(1)①已知:Ⅰ.2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g),△H=-159.47kJ•mol-1
+72.49kJ•mol-1=-86.98kJ•mol-1,
故答案为:-86.98;
②液氨可以发生电离:2NH3(l)?NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,还生成NH4Cl,该反应方程式为:COCl2+4NH3═CO(NH2)2+2NH4Cl,
故答案为:COCl2+4NH3═CO(NH2)2+2NH4Cl;
(2)①正反应△H>0,△S>0,△H-T△S<0反应自发进行,故该反应在高温下具有自发性,
故答案为:高温;
②相同温度下,氨气转化率越大,说明反应速率越快,催化剂的催化效果越好,由图可知Ru的催化效果最好;
b、c点均未到达平衡,c点温度高,且Ru比Fe的催化能力强,反应速率越快,氨气的转化率越高,
故答案为:Ru;b、c点均未到达平衡,c点温度高,且Ru比Fe的催化能力强,反应速率越快,氨气的转化率越高.
点评 本题考查反应热计算、反应自发性、读图获取信息能力等,侧重考查学生运用知识分析解决问题能力,难度中等.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | 可用了达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | 明矾净水只发生了物理变化 | |
| D. | CuSO4•5H20 是一种混合物 |
| A. | 若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| B. | 22.4LHCl中的分子数为NA | |
| C. | Na2O2与水充分作用生成0.1molO2时转移的电子数为0.2NA | |
| D. | 0.1mol铁与足量盐酸反应转移的电子数为0.3NA |
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10 min内反应的平均速率为 v(C)=0.050 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)>0.25 mol | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
| A. | 反应的还原产物是N2 | |
| B. | 消耗1 mol氧化剂,转移电子3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
| A. | 10g H2和10g N2 | B. | 1mol H2O和1g H2O | ||
| C. | 3.2g O2和2.24L的空气 | D. | 22gCO2和3.01×1023个O2 |
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |