题目内容
9.已知有如图所示物质相互转换关系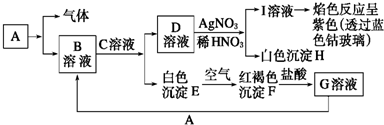
试回答:
(1)写出B的化学式FeCl2,D的化学式KCl;
(2)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)向G溶液中加入A的离子方程式2Fe3++Fe═3Fe2+;
向G溶液中加入铜片的离子方程式2Fe3++Cu═2Fe2++Cu2+;
(4)简述B溶液中阳离子的检验方法取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+.
分析 根据框图E转化为F的明显现象,可确定E为氢氧化亚铁,F是氢氧化铁,所以G是氯化铁,I溶液的焰色反应呈紫色,说明I中含有钾离子,含有钾离子的盐D和硝酸银反应生成白色沉淀H一定是氯化银,所以D是氯化钾,进而推得A是金属铁,B是氯化亚铁,C是氢氧化,据此答题.
解答 解:根据框图E转化为F的明显现象,可确定E为氢氧化亚铁,F是氢氧化铁,所以G是氯化铁,I溶液的焰色反应呈紫色,说明I中含有钾离子,含有钾离子的盐D和硝酸银反应生成白色沉淀H一定是氯化银,所以D是氯化钾,进而推得A是金属铁,B是氯化亚铁,C是氢氧化,
(1)B是氯化亚铁,化学式为FeCl2,B是氯化亚铁,化学式为KCl,
故答案为:FeCl2;KCl;
(2)由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)G是氯化铁,向G溶液中加入铁的离子方程式为 2Fe3++Fe═3Fe2+,向G溶液中加入铜片的离子方程式为 2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Fe═3Fe2+;2Fe3++Cu═2Fe2++Cu2+;
(4)亚铁离子易被氧化为三价铁,溶液中是否含有亚铁离子的检验方法:取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+,
故答案为:取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+.
点评 本题为框图式物质推断题,完成此题,关键是根据题干叙述,找出解题的突破口,然后根据框图,顺推得出其他物质的化学式,题目难度不大.

练习册系列答案
相关题目
19.下列实验可达到实验目的是( )
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将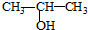 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
17.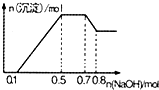 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
4.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(g)+2B(g)═C(g)+D(g),当下列物理量不再发生变化时,不能表明该反应达到平衡状态的是( )
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
14.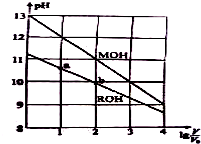 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH 的电离程度随lg $\frac{V}{{V}_{0}}$的增大而增大 | |
| B. | ROH 的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg $\frac{V}{{V}_{0}}$=2 时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
18.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同.试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
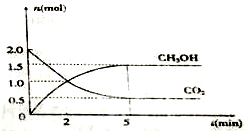 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是: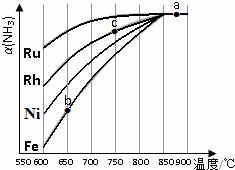 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛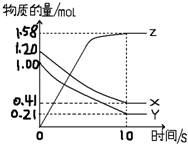 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: