题目内容
(1)分离沸点不同但又互溶的液体混合物,常用什么方法?试举例说明.
答:
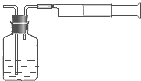
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法.
答:
(3)简述实验室检验Cl-的方法.
答: .
答:
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法.
答:
(3)简述实验室检验Cl-的方法.
答:
考点:物质分离、提纯的实验方案设计,物质的检验和鉴别的基本方法选择及应用
专题:化学实验基本操作
分析:(1)沸点不同但又互溶的液体混合物,可用蒸馏的方法分离;
(2)利用水和有机溶剂互不相溶,放出少量液体,加入液体根据是否分层来判断;
(3)可用硝酸银检验Cl-,在检验时要排除CO32- 等离子的影响.
(2)利用水和有机溶剂互不相溶,放出少量液体,加入液体根据是否分层来判断;
(3)可用硝酸银检验Cl-,在检验时要排除CO32- 等离子的影响.
解答:
解:(1)沸点不同但又互溶的液体混合物,可用蒸馏的方法分离,如苯和四氯化碳混合物,
故答案为:蒸馏,苯和四氯化碳混合物;
(2)利用水和有机溶剂互不相溶,设计判断方法,操作步骤为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,如果液体分层,则上层是水层.
故答案为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,如果液体分层,则上层是水层;
(3)因为AgCl不溶于水,不溶于稀硝酸,因此,在检验Cl-时,要加入硝酸银溶液,但是CO32- 等离子也能与硝酸银生成沉淀,但能溶于稀硝酸,因此,在加入硝酸银之前,一定要加入稀硝酸来除去CO32- 等离子.综上分析,检验某溶液中是否含有Cl-的操作方法是:在试液中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.故答案为:在试液中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.
故答案为:蒸馏,苯和四氯化碳混合物;
(2)利用水和有机溶剂互不相溶,设计判断方法,操作步骤为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,如果液体分层,则上层是水层.
故答案为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,如果液体分层,则上层是水层;
(3)因为AgCl不溶于水,不溶于稀硝酸,因此,在检验Cl-时,要加入硝酸银溶液,但是CO32- 等离子也能与硝酸银生成沉淀,但能溶于稀硝酸,因此,在加入硝酸银之前,一定要加入稀硝酸来除去CO32- 等离子.综上分析,检验某溶液中是否含有Cl-的操作方法是:在试液中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.故答案为:在试液中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.
点评:本题综合考查物质的分离、提纯以及检验的实验设计,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及操作方法,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列说法正确的是( )
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
恒温下将1molN2和3mol H2 在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s后测得NH3的体积分数为25%,则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2mol?L-1?s-1 |
| B、2s时N2的转化率为40% |
| C、2s时混合气体中n(N2):n(H2):n(NH3)═3:9:4 |
| D、2s时NH3的浓度为0.4mol/L |
下列离子在水溶液中一定能大量共存的是( )
| A、Na+、NH4+、SO42-、Cl- |
| B、OH-、Na+、H+、SO42- |
| C、Mg2+、Cl-、Na+、OH- |
| D、CO32-、H+、SO42-、K+ |
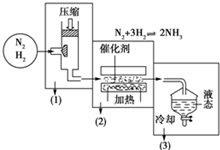 已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图:
已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图: 


 空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1
空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1