题目内容
2.有关化合物的Ksp 如表所示(25℃时):| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
分析 铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,利于将Zn2+和Fe2+分开,并根据Ksp计算锌开始沉淀的pH.
解答 解:如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:6;Zn(OH)2、Fe(OH)2的Ksp相近.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重考查学生的分析能力和计算能力,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 用过滤的方法可以除去食盐水中的泥沙 | |
| B. | 酒精灯加热烧瓶时不用垫石棉网 | |
| C. | 氯化氢气体能使干燥的蓝色石蕊试纸变红 | |
| D. | 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞 |
13.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )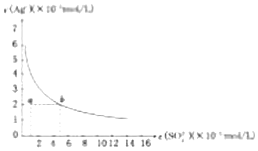

| A. | 在SO42-浓度为3mol/L的溶液中肯定不存在Ag+ | |
| B. | 0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | 在任何存在Ag2SO4的悬浊溶度积中c(Ag+)=2c(SO42-) | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
10.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 | B. | CH3CH2CH2OH 1-丙醇 | ||
| C. |  间二甲苯 | D. |  2-甲基-2-丙烯 |
7.下列物质一定表示一种纯净物的是( )
| A. | C3H6 | B. | C2H4 | C. | [-CH2-CH2-]n | D. | C4H10 |
14.已知反应2N2O5(g)?4NO2(g)+O2(g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下:
请回答下列问题:
(1)该速率表达式中,m=1,k正=0.35min-1.
(2)若某时刻c(N2O5)=0.100mol•L-1,则v正≈0.035mol.L-1.min-1.
(3)第4min时,该可逆反应v正≥(填“>”“<”或“=”或“≥”)v逆.
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
(1)该速率表达式中,m=1,k正=0.35min-1.
(2)若某时刻c(N2O5)=0.100mol•L-1,则v正≈0.035mol.L-1.min-1.
(3)第4min时,该可逆反应v正≥(填“>”“<”或“=”或“≥”)v逆.
11.等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1 ②它们所含的O原子数目之比为1:2 ③它们所含的原子数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11.
①它们所含的分子数目之比为1:1 ②它们所含的O原子数目之比为1:2 ③它们所含的原子数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11.
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
12.下列有关离子化合物、共价化合物的性质描述,不正确的是( )
| A. | 离子化合物都能溶于水,而共价化合物都不溶于水 | |
| B. | 离子化合物的熔点一般较高,而共价化合物的熔点一般较低 | |
| C. | 离子化合物的硬度一般较大,而共价化合物的硬度一般较小 | |
| D. | 离子化合物在熔融条件下能够导电,而共价化合物在熔融条件下不能导电 |