题目内容
同温同压下,等质量的CO和CO2气体相比较,下列叙述中正确的是( )
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
考点:物质的量的相关计算
专题:计算题
分析:等质量的CO和CO2,设质量均为m,物质的量之比为
:
=11:7.
A.CO和CO2分子均含有1故C原子,则含有C原子数目之比等于二者物质的量之比;
B.同温同压下,气体的体积之比等于物质的量之比;
C.同温同压下,气体密度之比等于摩尔质量的之比;
D.分子数之比等于物质的量之比.
| m |
| 28 |
| m |
| 44 |
A.CO和CO2分子均含有1故C原子,则含有C原子数目之比等于二者物质的量之比;
B.同温同压下,气体的体积之比等于物质的量之比;
C.同温同压下,气体密度之比等于摩尔质量的之比;
D.分子数之比等于物质的量之比.
解答:
解:等质量的CO和CO2,设质量均为m,物质的量之比为
:
=11:7.
A.CO和CO2分子均含有1故C原子,则含有C原子数目之比等于二者物质的量之比,所含碳原子数比为11:7,故A错误;
B.同温同压下,气体的体积之比等于物质的量之比,则CO和CO2体积之比为11:7,故B正确;
C.同温同压下,气体密度之比等于摩尔质量的之比,CO和CO2密度比为28::4=7:11,故C正确;
D.分子数之比等于物质的量之比,CO和CO2的分子数比为11:7,故D错误,
故选BC.
| m |
| 28 |
| m |
| 44 |
A.CO和CO2分子均含有1故C原子,则含有C原子数目之比等于二者物质的量之比,所含碳原子数比为11:7,故A错误;
B.同温同压下,气体的体积之比等于物质的量之比,则CO和CO2体积之比为11:7,故B正确;
C.同温同压下,气体密度之比等于摩尔质量的之比,CO和CO2密度比为28::4=7:11,故C正确;
D.分子数之比等于物质的量之比,CO和CO2的分子数比为11:7,故D错误,
故选BC.
点评:本题考查物质的量有关计算、阿伏伽德罗定律等,难度不大,注意根据PV=nRT理解阿伏伽德罗定律及其推论.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列关于化学用语叙述正确的是( )
A、丙烷分子的球棍模型: |
B、甲醛的电子式: |
| C、乙醇的结构简式:C2H6O |
| D、乙烯的结构式:CH2=CH2 |
下列化学用语表述一定正确的是( )
A、甲醛的电子式: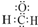 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列广告用语在科学性上没有错误的是( )
| A、这种饮料中不含任何化学物质 |
| B、这种蒸馏水绝对纯净,其中不含任何离子 |
| C、这种口服液含丰富的N、P、Zn等微量元素 |
| D、没有水就没有生命 |
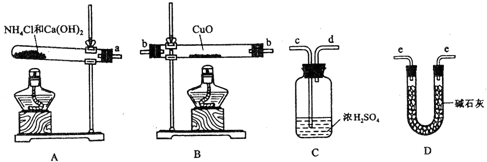
下列实验现象预测正确的是( )
A、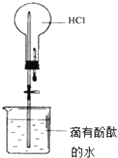 打开止水夹,烧瓶内出现红色喷泉 |
B、 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、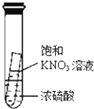 静置一段时间,小试管内有晶体析出 |
D、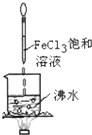 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |