题目内容
19.某化学反应进行到一定程度时,达到化学平衡状态,则该反应一定是( )| A. | 所有的化学反应 | B. | 可逆反应 | ||
| C. | 氧化还原反应 | D. | 气体物质之间的反应 |
分析 当一个可逆反应进行到正反应速率与逆反应速率相等的时候,就达到了“化学平衡”.
解答 解:化学平衡状态的建立条件:一个可逆反应在开始进行之初,假设反应物浓度最大,生成物的浓度为零,则正反应速率大于逆反应速率,反应进行后,反应物被消耗,浓度减小,速率减小,生成物不断积累,浓度增大,速率增大,反应进行到一定程度时,正反应速率与逆反应速率相等,各物质的浓度与含量不再改变,达到平衡状态,所以化学平衡是可逆反应的特征.
故选B.
点评 本题考查学生可逆反应的化学平衡状态的建立知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
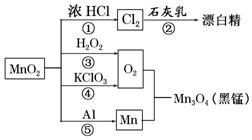

| A. | 只有反应①②④属于氧化还原反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
14.化学与生活密切相关,下列说法不正确的是( )
| A. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl颗粒方法来防止道路结冰 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 在医学上用BaSO4做钡餐,是因为Ba2+对人体无毒 |
4. 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.对反应2A(S)+B(g)?2C(g),能增大反应速率的措施是( )
| A. | 增加A的量 | B. | 增大体系容积 | C. | 恒容移去部分C | D. | 升高体系温度 |
4. 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O.
(2)地康法制备氯气的反应为4HCl(g)+O2(g)$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,1molH-Cl、1molCl-Cl、1molO-O断裂时分别需要吸收431J、243kJ、489kJ的能量,则1molO-H断裂时需吸收的能量为460.65kJ.
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00mL,在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,则滴定终点时溶液中c(Cl-)=8.90×10-6mol/L.[已知:Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4molClO2(g),发生反应:4ClO2)(g)?2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
已知:T3>T1,V2>V1.
①该反应中Cl2O是还原产物(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K=25.63.
③V2>(填“>”、“<”或“=”)V3.
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为e<a=d(用字母表示);与a容器相比,d容器中改变的一个实验条件是加入催化剂,其判断依据是ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变.
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O.
(2)地康法制备氯气的反应为4HCl(g)+O2(g)$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,1molH-Cl、1molCl-Cl、1molO-O断裂时分别需要吸收431J、243kJ、489kJ的能量,则1molO-H断裂时需吸收的能量为460.65kJ.
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00mL,在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,则滴定终点时溶液中c(Cl-)=8.90×10-6mol/L.[已知:Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4molClO2(g),发生反应:4ClO2)(g)?2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
①该反应中Cl2O是还原产物(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K=25.63.
③V2>(填“>”、“<”或“=”)V3.
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为e<a=d(用字母表示);与a容器相比,d容器中改变的一个实验条件是加入催化剂,其判断依据是ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变.
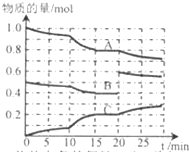 在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题: