题目内容
用NA表示阿伏加德罗常数,下列有关叙述错误的是( )
| A、臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B、标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C、在常温常压下,3.4gNH3含有的电子数是2NA |
| D、含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.依据氧元素守恒结合n=
和分子式计算原子物质的量;
B.单质气体可能为单原子分子;
C.1molNH3含有10mol电子;
D.根据硫酸铝中铝离子与硫酸根离子的对应关系进行计算.
| m |
| M |
B.单质气体可能为单原子分子;
C.1molNH3含有10mol电子;
D.根据硫酸铝中铝离子与硫酸根离子的对应关系进行计算.
解答:
解:A.氧气和臭氧组成的4.8g混合气体中,依据氧元素守恒,氧元素物质的量=
=0.3mol,所以含有0.3 NA个氧原子,故A正确;
B.单质气体可能为单原子分子,含有原子数为0.1NA,故B错误;
C.1molNH3含有10mol电子,3.4gNH3的物质的量是0.2mol,含有2mol电子,故C正确;
D.硫酸铝化学式Al2(SO4)3=2Al3++3SO42-,5.4 gAl3+的物质的量为0.2mol,则溶液中 SO42-的物质的量为0.3mol,故D正确.
故选B.
| 4.8g |
| 16g/mol |
B.单质气体可能为单原子分子,含有原子数为0.1NA,故B错误;
C.1molNH3含有10mol电子,3.4gNH3的物质的量是0.2mol,含有2mol电子,故C正确;
D.硫酸铝化学式Al2(SO4)3=2Al3++3SO42-,5.4 gAl3+的物质的量为0.2mol,则溶液中 SO42-的物质的量为0.3mol,故D正确.
故选B.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
下列反应能用化合直接制得的是( )
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
| A、①②③⑤ | B、②⑤ |
| C、②③⑤ | D、全部 |
 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
下列各说法中,正确的是( )
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 下列关于该反应的叙述不正确的是( )
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称.茶多酚中的活性物质没食子儿茶素(EGC)具解毒和抗辐射作用,能有效地阻止放射性物质侵入骨髓,其结构如图所示.关于EGC的下列叙述中正确的是:( )

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
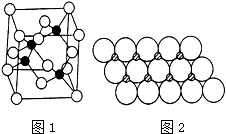 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题: