题目内容
9.根据下列要求完成各题:判断对错(若正确打“√”,若错误打“×”)
(1)在标准状况下,22.4L任何气体都含有约为6.02×1023 个原子×(判断对错)
(2)在常温常压下,11.2L N2 含有的分子数约为0.5×6.02×1023个×(判断对错)
(3)标准状况时,任何气体摩尔体积约为22.4L/mol√(判断对错)
(4)0.1molNaCl固体溶于1L水配制成0.1mol/L溶液×(判断对错)
(5)在相同温度和压强下,相同物质的量不同气体具有相同的原子数×(判断对错)
(6)用苯萃取碘水中的碘,分液时有机层从分液漏斗的上端倒出√.(判断对错)
分析 (1)气体分为单原子、双原子和多原子,含有分子的物质的量为1mol,而含有原子的物质的量不一定为1mol;
(2)常温常压下,气体摩尔体积不能使用22.4L/mol计算;
(3)标准状况下任何气体的气体摩尔体积都约为22.4L/mol;
(4)0.1molNaCl固体溶于1L水,所得溶液的体积不是1L;
(5)物质的量相的气体分子中含有的原子的物质的量不一定相同;
(6)苯的密度较小,需要从而从分液漏斗的上端倒出有机层.
解答 解:(1)在标准状况下,22.4L任何气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,1mol气体含有原子的物质的量不一定为1mol,则含有原子数不一定为6.02×1023,故该说法错误,
故答案为:×;
(2)不是标准状况下,不能使用标准状况下的气体摩尔体积计算11.2L N2的物质的量,则含有的分子数不一定为0.5×6.02×1023,故该说法错误,
故答案为:×;
(3)标准状况下,1mol任何气体所占有的体积都约为22.4L,则标准状况时任何气体摩尔体积约为22.4L/mol,故该说法正确,
故答案为:√;
(4)0.1molNaCl固体溶于1L水,所得溶液的体积不是1L,所配制成的溶液浓度不是0.1mol/L,故该说法错误,
故答案为:×;
(5)气体分为单原子、双原子和多原子,则相同物质的量不同气体具有相同的原子数不一定相同,故该说法错误,
故答案为:×;
(6)用苯萃取碘水中的碘,溶有碘单质的有机层在上层,分液时有机层从分液漏斗的上端倒出,故该说法正确,
故答案为:√.
点评 本题考查了物质的量的计算及分液操作方法,题目难度不大,明确气体摩尔体积的使用条件为解答关键,注意掌握常见化学实验基本操作方法,试题培养了学生的灵活应用能力.

 53天天练系列答案
53天天练系列答案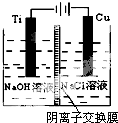 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
则方法a发生的热化学方程式是:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1.
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,钛极附近的pH值增大(填“增大”“减小”或“不变”).
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
| 序号 | 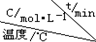 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min)
③催化剂的催化效率:实验①<实验②(填“>”或“<”).
I.配制100mL 0.10mol/L NaOH标准溶液.
II.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准
NaOH溶液进行滴定.
III.重复上述滴定操作2~3次,记录数据如下.
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测HCl溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
(3)排去碱式滴定管中气泡的方法应采用如图丙的操作,然后挤压玻璃球使尖嘴部分充满碱液.

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有EF(多选扣分).
A.滴定终点读数时俯视读数 B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥 D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失.
| A. | 臭氧具有氧化性,可用作自来水的消毒剂 | |
| B. | 活性炭具有还原性,可用作制糖业脱色剂 | |
| C. | 氢氟酸具有弱酸性,可用作玻璃的蚀刻剂 | |
| D. | 氨气具有弱碱性,可用作食品工业制冷剂 |
| A. | CuO、Na2O和Na2O2都是碱性氧化物 | |
| B. | SO2能与碱反应生成盐和水,因此SO2属于酸性氧化物 | |
| C. | NH4Cl不含金属阳离子,不属于盐 | |
| D. | 金属氧化物都是碱性氧化物 |
 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
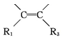 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+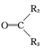
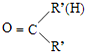 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$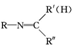 +H2O
+H2O  +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O .
.  (写出其中一种的结构简式).
(写出其中一种的结构简式).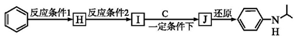 ,
, .
.