题目内容
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.由质量计算粒子数,需要知道原子的结构知识;
B.NaHS04晶体中存在钠离子和硫酸氢根离子;
C.依据n=
计算44g二氧化碳的物质的量,依据一个二氧化碳分子中含有2个氧原子计算解答;
D.NO2和N2O4的最简式相同,只需要计算46g NO2中原子数.
B.NaHS04晶体中存在钠离子和硫酸氢根离子;
C.依据n=
| m |
| M |
D.NO2和N2O4的最简式相同,只需要计算46g NO2中原子数.
解答:
解:A.16g甲烷(14CH4)的物质的量为:16g÷18g/mol═
mol,每mol甲烷(14CH4)含中子数为8mol,故16g甲烷所含的中子数为
NA,故A错误;
B.1.2g NaHS04晶体的物质的量是0.01mol,NaHS04晶体中存在钠离子和硫酸氢根离子,阳离子和阴离子的总数为0.02NA,故B错误;
C.44g CO2气体的物质的量n=
=1mol,1个二氧化碳分子中含有2个氧原子,所以44g CO2气体含有氧原子的个数为2NA,故C正确;
D.NO2和N2O4的最简式相同,只需要计算46g NO2中原子数=
×3×NA=3NA,故D正确;
故选:AB.
| 8 |
| 9 |
| 64 |
| 9 |
B.1.2g NaHS04晶体的物质的量是0.01mol,NaHS04晶体中存在钠离子和硫酸氢根离子,阳离子和阴离子的总数为0.02NA,故B错误;
C.44g CO2气体的物质的量n=
| 44g |
| 44g/mol |
D.NO2和N2O4的最简式相同,只需要计算46g NO2中原子数=
| 46g |
| 46g/mol |
故选:AB.
点评:本题考查了阿伏伽德罗常数的有关计算及应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在一体积固定的密闭 容器中,进行化学反应:2X(g)+Y(s)?Z(g)+W(g),若其化学平衡常数(K)和温度(℃)的关系如下表:对该反应而言,下列说法正确的是( )
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A、该反应正反应为放热反应 |
| B、K越大,反应物的转化率越大 |
| C、温度不变,增加X的用量,K增大 |
| D、达平衡后,加入催化剂,平衡向正反应方向移动 |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
| A、CuCl2(CuSO4) |
| B、AgNO3(H2O) |
| C、NaCl(盐酸) |
| D、CuSO4(CuO) |
下列各组溶液不加任何试剂,只需要用试管和滴管两两互滴就能鉴别的是( )
| A、盐酸、氢氧化钠、氯化钠 |
| B、氢氧化钠、氢氧化钡、硫酸 |
| C、硫酸氢钠、碳酸钠、氢氧化钠 |
| D、硫酸铜、盐酸、硫酸 |
下列实验操作中错误的是( )
| A、进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
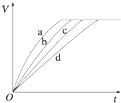 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )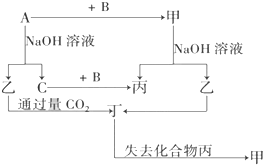 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.