题目内容
11.某有机物 0.100mol 完全燃烧,生成 7.20g 水和 15.68L(标准状况)二氧化碳.又测定出此有机物的蒸气与相同状况下同体积的氢气质量比为 54:1.(1)求此有机物的分子式.(要求有计算过程)
(2)已知该有机物与 FeCl3 溶液反应呈紫色,
推断该有机物可能的结构简式.
分析 (1)根据该有机物的蒸气与相同状况下同体积的氢气质量比为54:1可确定其摩尔质量,然后根据质量守恒定律确定该有机物分子中含有C、H的说明,再利用C、H的总原子量确定是否含有O及含有氧原子数目,从而确定其分子式;
(2)该有机物与FeCl3溶液反应呈紫色,则该有机物分子中一定含有苯环和羟基,结合其分子式可知该有机物还应该还会有1个甲基,据此写出其可能的结构简式.
解答 解:(1)此有机物的蒸气与相同状况下同体积的氢气质量比为 54:1,则该有机物的摩尔质量为:2g/mol×54=108g/mol,
7.2gH2O中H原子的物质的量为:$\frac{7.2g}{18g/mol}$×2=0.8mol,标况下15.68LCO2的物质的量为:$\frac{15.68L}{22.4L/mol}$=0.7mol,则n(C)=0.7mol,
该有机物分子中含有C、H原子数分别为:N(C)=$\frac{0.7mol}{0.1mol}$=7、N(H)=$\frac{0.8mol}{0.1mol}$=8,
含有C、H的总原子量为:12×7+1×8=92<108,说明该有机物分子中含有O元素,含有氧原子数目为:$\frac{108-92}{16}$=1,
所以该有机物的分子式为:C7H8O,
答:该有机物的分子式为C7H8O;
(2)该有机物与FeCl3溶液反应呈紫色,则该有机物分子中一定含有苯环和羟基,还应该还会有1个甲基,
所以该有机物可能的结构简式为: 、
、 、
、 ,
,
答:该有机物可能的结构简式分别为 、
、 、
、 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握有机物同分异构体的书写原则,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19. 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,其中Fe2O3是( )
 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,其中Fe2O3是( )
| A. | 氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 还原剂 | D. | 既不是氧化剂又不是还原剂 |
16.每年6月5日为世界环境日.下列有关环保建议不能采纳的是( )
| A. | 开发利用太阳能 | B. | 提倡垃圾分类处理 | ||
| C. | 改进汽车尾气净化技术 | D. | 将工业废水直接排放 |
1.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )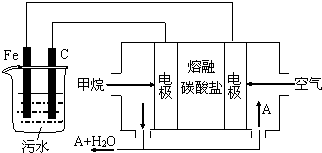

| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |