题目内容
6.下列各组物质中,互为同位素的是C(填选项)互为同素异形体的是A(填选项)
互为同分异构体的是E(填选项)
互为同系物的是BD(填选项)
A.O2和O3 B.CH3CH3和C4H10
C.37Cl和35Cl D.CH2=CHCH3和CH3CH2CH=CHCH3
E.CH3C(CH3)2CH2CH2CH3和CH3CH2CH2CH2CH2CH2CH3.
分析 同种元素形成的不同单质互为同素异形体;
质子数相同质量数(或中子数)不同的原子互称同位素;
具有相同分子式而结构不同的化合物互为同分异构体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等.
解答 解:C.37Cl和35Cl质子数相同,中子数不同,均属于氯元素的原子,互为同位素;
A.O2和O3 均是氧元素形成的不同种单质,互为同素异形体;
E.CH3C(CH3)2CH2CH2CH3和CH3CH2CH2CH2CH2CH2CH3分子式相同,结构不同,属于同分异构体;
B.CH3CH3和C4H10D.CH2=CHCH3和CH3CH2CH=CHCH3结构相似,分子组成上相差1个或者若干个CH2原子团,属于同系物;
故答案为:C;A;E;BD.
点评 本题主要考查的是同系物、同分异构体、同位素的概念,属于常考题类型之一,注意概念间的区别,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.制取无水乙醇时,下列物质中,哪个最适宜用于除去乙醇中微量的水( )
| A. | 无水氯化钙 | B. | 无水硫酸镁 | C. | 金属钠 | D. | 金属镁 |
17.合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.
(1)已知:①N2(g)+O2(g)═2NO(g)△H1
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用△H1、△H2、△H3表达)
(2)图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
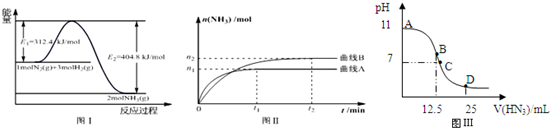
①下列说法正确的是AE.
A.△H=-92.4kJ•mol-1
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.该反应的平衡常数KA<KB
F.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/4t1mol•L-1•min-1
②下列能说明该反应达到平衡状态的是C
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如表:
①理论上,为了增大平衡时H2的转化率,可采取的措施是增大压强、适当增大氮氢比、及时分离出产物中的NH3(要求答出两点).
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入0.2mol/L的HN3溶液,溶液的pH变化曲线如图Ⅲ所示.A、B、C、D 四个点中,水的电离程度最大的是B;D点时溶液中各离子浓度大小顺序为c(N3-)>c(NH4+)>c(H+)>c(OH-).
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
(1)已知:①N2(g)+O2(g)═2NO(g)△H1
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用△H1、△H2、△H3表达)
(2)图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.

①下列说法正确的是AE.
A.△H=-92.4kJ•mol-1
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.该反应的平衡常数KA<KB
F.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/4t1mol•L-1•min-1
②下列能说明该反应达到平衡状态的是C
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入0.2mol/L的HN3溶液,溶液的pH变化曲线如图Ⅲ所示.A、B、C、D 四个点中,水的电离程度最大的是B;D点时溶液中各离子浓度大小顺序为c(N3-)>c(NH4+)>c(H+)>c(OH-).
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
1.常温下,下列溶液中粒子浓度关系正确的是( )
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
18.下列物质的包装箱应贴上右图标志的是( )


| A. | 硫酸钠 | B. | 酒精 | C. | 浓硫酸 | D. | 氢氧化钠 |
15.下列有关化学用语使用正确的是( )
| A. | 磷(P)基态原子最外层轨道表示式: | |
| B. | 钢铁发生吸氧腐蚀的正极反应式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的实验式:C6H12O6 | |
| D. | 氰基的电子式: |