题目内容
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
分析 A、浓硫酸中除了硫酸、浓磷酸中除了磷酸外,水也含氧原子;
B、活泼金属和稀硫酸反应生成氢气,且生成1mol氢气需转移2mol电子;
C、二氧化硫和水的反应为可逆反应;
D、合成氨的反应为可逆反应,不能进行彻底.
解答 解:A、浓硫酸中除了硫酸、浓磷酸中除了磷酸外,水也含氧原子,故溶液中含有的氧原子的个数大于4NA个,故A错误;
B、活泼金属和稀硫酸反应生成氢气,且生成1mol氢气需转移2mol电子,故当转移2NA个电子时,能生成1mol氢气,在标况下为22.4L,故B正确;
C、二氧化硫和水的反应为可逆反应,不能进行完全,且亚硫酸为弱酸,在溶液中部分电离,则溶液中含有的亚硫酸分子小于0.1NA个,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故生成的共价键个数小于6NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.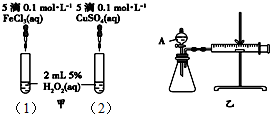 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
4.常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol•L-1,则该溶液的pH可能是( )
| A. | 4 | B. | 7 | C. | 8 | D. | 11 |
1.化学在生产和生活中有重要的应用,下列说法正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
8. 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:SO2-2e-+2H2O=4H++SO42-;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O )△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=0.17,该反应的△H<0(填“>”或“<”).
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{b}{a}$的值>1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆>V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是A.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:SO2-2e-+2H2O=4H++SO42-;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O )△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{b}{a}$的值>1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆>V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是A.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
5.一个-C3H7和一个-C3H7O取代苯环上的氢原子,形成的有机物中能与金属钠反应的同分异构体有(不考虑立体异构)( )
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
2.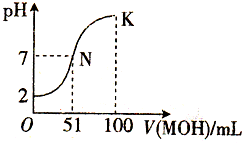 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
3.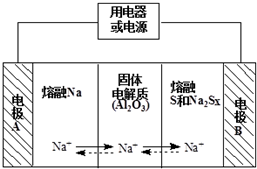 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |