题目内容
2.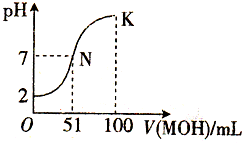 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
分析 A.根据0.01mol/L的HA溶液的pH判断HA;N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,据此判断MA溶液的酸碱性;
B.K点溶液呈碱性,稀释过程中氢氧根离子浓度减小,结合水的离子积不变分析氢离子浓度变化;
C.在N点时混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知c(A-)=c(M+);
D.K点溶液pH>7,c(OH-)>c(H+),根据电荷守恒判断溶液中各离子浓度大小.
解答 解:A.根据图象可知,0.01mol•L-1HA溶液中pH=2,则HA在溶液中完全电离,则HA为强酸;100mL 0.01mol•L-1HA溶液中加入51mL 0.02mol•L-1MOH溶液时,溶液的pH=7,则加入50mL该MOH溶液时,混合液为酸性,数目MOH为弱碱,则MA为强酸弱碱盐,其溶液呈酸性,MA溶液的pH<7,故A错误;
B.K点溶液呈碱性,稀释后溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故B错误;
C.N点溶液呈中性,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(A-)=c(M+),故C错误;
D.在K点时混合溶液体积是碱溶液的2倍,溶液pH>7,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(M+)>c(A-),溶液中各离子浓度大小为:c(M+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了酸碱混合时的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,需要根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点;要求学生能够根据电荷守恒、盐的水解、物料守恒判断溶液中各离子浓度大小.

 应用题作业本系列答案
应用题作业本系列答案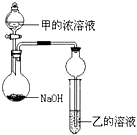 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5-3 | +7-1 | +6-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径 Y>Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是氢氧化钠遇水放热,增大了OH-离子的浓度,有利于氨气的逸出.一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+.
(4)T、X两种元素形成XT5固体,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则其电子式为
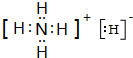 .
.(5)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
(6)常温下,Z2Y2是一种橙黄色液体,广泛用于橡胶工业的硫化机,其分子结构与双氧水分子相似.试写出其结构式Cl-S-S-Cl.
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
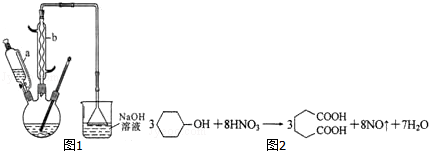
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min,直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管,使用时要从下口通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
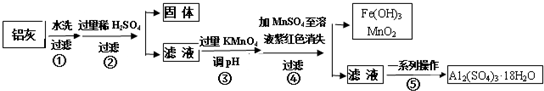
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
 .
.
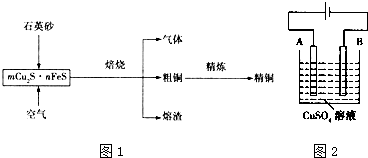
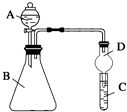 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.