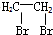题目内容
6.下列有关Fe2(SO4)3溶液的叙述正确的是( )| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2 g Fe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
分析 硫酸铁在溶液中电离出铁离子和硫酸根离子,
A.铁离子与硫氰根离子反应生成硫氰化铁;
B.该离子方程式两边总电荷不守恒;
C.1 L 0.1 mol•L-1该溶液中含有硫酸铁的物质的量为0.1mol,根据质量守恒定律计算出生成铁的物质的量及质量;
D.硫酸铁与氢氧化钡按照物质的量1:3反应,铁离子与硫酸根离子的物质的量之比应该为2:3.
解答 解:A.SCN-与铁离子发生络合反应,在溶液中不能大量共存,故A错误;
B.铁离子和KI溶液发生氧化还原反应,正确的离子方程式为:2Fe3++2I-═2Fe2++I2,故B错误;
C.1 L 0.1 mol•L-1该溶液中含有硫酸铁的物质的量为:0.1mol/L×1L=0.1mol,0.1mol硫酸铁中含有0.2mol铁离子,根据质量守恒定律,与足量锌反应生成Fe的物质的量为0.2mol,质量为:56g/mol×0.2mol=11.2g,故C正确;
D.Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故D错误;
故选C.
点评 本题考查较为综合,涉及离子共存、离子方程式书写、氧化还原反应的计算等知识,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子方程式的书写原则,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关实验装置、操作,不能实现相应实验目的是( )
| A | B | C | D | |
| 装置 |  |  |  |  |
| 目的 | 用NaOH溶液除去溴苯中单质溴 | 证明浓硫酸有脱水性、强氧化性 | 确定Ksp(AgCl)、Ksp(AgI)的相对大小 | 观察水能否全部流下判断装置气密性 |
| A. | A | B. | B | C. | C | D. | D |
1.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
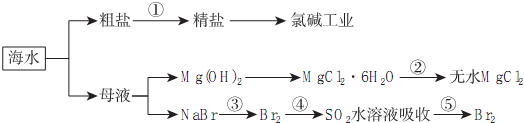

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被氧化 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
11.东晋葛洪在《抱朴子》中写道“扶南生金刚,生水底石上,如钟乳状,体似紫石英,可以刻玉,人没水取之,虽铁椎之亦不能伤.”文中所述“金刚”可能为( )
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
18.下列说法正确的是( )
| A. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 | |
| B. | 棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
16.下列装置图中的实验方案,能达到实验目的是( )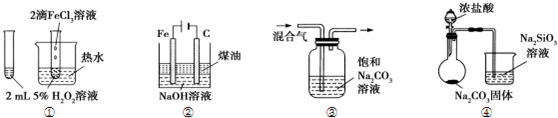

| A. | ①验证FeCl3对H2O2分解反应有催化作用 | |
| B. | ②制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | ③除去CO2气体中混有的SO2 | |
| D. | ④比较HCl、H2CO3和H2SiO3的酸性强弱 |
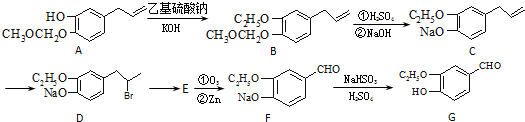
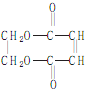 )的合成路线如下图:
)的合成路线如下图: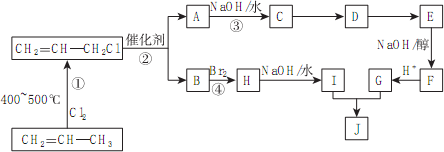
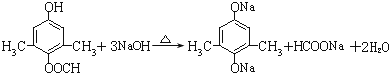
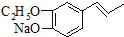 .
.
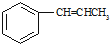 为原料制备
为原料制备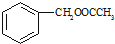 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: