题目内容
18.下列说法正确的是( )| A. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 | |
| B. | 棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
分析 A.乙醇能使蛋白质发生变性,而过氧化氢、次氯酸钠具有强氧化性可杀菌消毒;
B.丝、羽毛的成分为蛋白质,含N元素等;
C.“光化学烟雾”与N的氧化物有关、“硝酸型酸雨”与二氧化氮有关;
D.光导纤维的成分为二氧化硅.
解答 解:A.乙醇能使蛋白质发生变性,而过氧化氢、次氯酸钠具有强氧化性可杀菌消毒,均作消毒剂,但原理不同,故A错误;
B.丝、羽毛的成分为蛋白质,含N元素等,而棉、塑料及合成橡胶完全燃烧都只生成CO2和H2O,故B错误;
C.“光化学烟雾”与N的氧化物有关、“硝酸型酸雨”与二氧化氮有关,形成都与氮氧化合物有关,故C正确;
D.光导纤维的成分为二氧化硅,为无机材料,而新型材料聚酯纤维属于有机高分子化合物,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、反应类型及化学与生活等为解答的关键,侧重分析与应用能力的考查,注意化学与生活的密切联系,题目难度不大.

练习册系列答案
相关题目
8. 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx2.0 mL,理由是保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的.
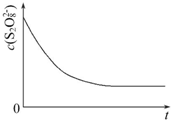
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
6.下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2 g Fe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
13.常温下,下列各组离子在指定溶液中一定可以大量共存的是( )
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
3.甲苯( )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 8种 | B. | 12种 | C. | 10种 | D. | 16种 |
10.下列叙述中正确的是( )
| A. | K3C60在熔融状态下能够导电,所以K3C60是电解质 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | 胶体和溶液的本质区别在于能否发生丁达尔现象 | |
| D. | 变化过程中化学键被破坏,则一定发生化学变化 |
7.X、Y、Z、W均为短周期主族元素,原子序数依次增加,且最外层电子数分别为5、6、6、7,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
| A. | 阴离子的还原性:Z>Y | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为NA |
 原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.