题目内容
3.X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
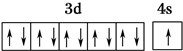 ,R在周期表中位于ds区.
,R在周期表中位于ds区.(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
分析 X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大.X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则X原子的电子排布式为1s22s22p2,则X为碳元素;Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则Y为氮元素;Z元素的族序数是其周期数的3倍,Z处于第二周期,最外层电子数为6,则Z为氧元素;Q为前4周期中电负性最小的元素,即为金属性最强的元素,为K元素;原子的第四电离能剧增,表现+3价,原子序数大于氧元素,故W为Al元素;元素R位于周期表的第11列,R处于第四周期,为Cu元素,据此解答.
解答 解:X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大.X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则X原子的电子排布式为1s22s22p2,则X为碳元素;Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则Y为氮元素;Z元素的族序数是其周期数的3倍,Z处于第二周期,最外层电子数为6,则Z为氧元素;WQ为前4周期中电负性最小的元素,即为金属性最强的元素,为K元素;原子的第四电离能剧增,表现+3价,原子序数大于氧元素,故W为Al元素;元素R位于周期表的第11列,R处于第四周期,为Cu元素.
(1)Cu原子核外有29个电子,其核外电子排布式为1s22s22p63s23p63d104s1,其价电子排布式为3d104s1,所以铜基态原子的价电子排布图为 ,该元素位于ds区,
,该元素位于ds区,
故答案为: ;ds;
;ds;
(2)同一周期中,第一电离能随着原子序数的增大而呈增大趋势,但第ⅤA族元素原子为半满稳定状态,第一电离能大于相邻元素的,所以这三种元素的第一电离能大小顺序是:N>O>C,
故答案为:N>O>C;
(3)Q为K元素,其焰色反应是紫色,电子从较高能量的激发态跃迁到较低能量的激发态及基态时,以光的形式释放能量,所以许多金属盐都可以发生焰色反应,
故答案为:紫;电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量;
(4)Q为K元素,金属K晶体为体心立方密堆积,配位数为8,
故答案为:体心立方密堆积;8;
(5)[Al(OH)4]-中氢原子和氧原子之间存在极性共价键,为σ键,铝原子含有空轨道,氧原子含有孤电子对,所以该离子中含有配位键,
故选:a c d.
点评 本题考查结构性质位置关系、核外电子排布规律、电离能、化学键、晶胞结构等,难度中等,推断元素是解题关键,熟记中学常见晶胞结构,理解同周期第一电离能异常情况.

(1)某同学取雨水样品1份,每隔一段时间测定该雨水样品的PH,所得数据如下:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
①雨水样品PH变化的原因(用化学方程式表示)2H2SO3+O2=2H2SO4.
②由以上信息可知.同物质的量浓度的硫酸和碳酸溶液,PH较大的是碳酸或H2CO3溶液.
③该样品雨水放置1小时,PH最接近D.
A:5.0 B:4.61 C:4.63 D:4.69
(2)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.称“钙基固硫法”请写出燃烧时有关反应的化学方程式
①S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
②CaO+SO2═CaSO3.
③2CaSO3+O2═2CaSO4.
(3)你认为减少酸雨产生的途径可采用的措施是C[单选题].
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A、①②③B、②③④⑤C、①③⑤D、①③④⑤
| A. | 熔融态物质快速冷却 | B. | 熔融态物质凝固 | ||
| C. | 气态物质凝华 | D. | 溶质从溶液中析出 |
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1mol/L NaOH溶液中加入1mL0.1mol/LMgCl2溶液,然后再向混合溶液中滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 第一次剩余4.8g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0mol•L-1 | |
| C. | 原混合物中铜和铁各0.075mol | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12LNO |
| A. | 钠与氧气 | B. | 氢氧化钠和二氧化碳 | ||
| C. | 氢氧化钠和氯化铝 | D. | 氧化钠和二氧化碳 |
 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: