题目内容
14.我国农业遭受酸雨而造成损失每年高达15亿多元.为有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制去划分方案》等法规(1)某同学取雨水样品1份,每隔一段时间测定该雨水样品的PH,所得数据如下:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
①雨水样品PH变化的原因(用化学方程式表示)2H2SO3+O2=2H2SO4.
②由以上信息可知.同物质的量浓度的硫酸和碳酸溶液,PH较大的是碳酸或H2CO3溶液.
③该样品雨水放置1小时,PH最接近D.
A:5.0 B:4.61 C:4.63 D:4.69
(2)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.称“钙基固硫法”请写出燃烧时有关反应的化学方程式
①S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
②CaO+SO2═CaSO3.
③2CaSO3+O2═2CaSO4.
(3)你认为减少酸雨产生的途径可采用的措施是C[单选题].
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A、①②③B、②③④⑤C、①③⑤D、①③④⑤
分析 (1)①雨水的pH值变小的原因是由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,2H2SO3+O2=2H2SO4,从而使雨水的酸性增强;
②碳酸为弱酸,部分电离;
③该样品雨水放置1小时,PH介于4.79~4.62之间;
(2)煤中含有S,与氧气反应生成SO2,SO2与CaO反应生成CaSO3,进一步反应生成CaSO4;
(3)少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成.把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能有效地防止酸雨的形成.
解答 解:(1)①雨水的pH值变小的原因是由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,方程式为2H2SO3+O2=2H2SO4,从而使雨水的酸性增强,故答案为:2H2SO3+O2=2H2SO4;
②碳酸为弱酸,部分电离,则同物质的量浓度的硫酸和碳酸溶液,PH较大的是碳酸或H2CO3,故答案为:碳酸或H2CO3;
③该样品雨水放置1小时,PH介于4.79~4.62之间,由2~3小时pH之差可知,应比4.62大0.03以上,应接近4.69,故答案为:D;
(2)煤中含有S,与氧气反应生成SO2,反应方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,SO2与CaO反应生成CaSO3,反应方程式为CaO+SO2═CaSO3,进一步反应生成CaSO4,
反应方程式为2CaSO3+O2═CaSO4,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4;
(3)把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能从源头有效地防止酸雨的形成,少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成.
故选C.
点评 本题考查二氧化硫的污染及治理,侧重于基础知识的考查,注意把握二氧化硫的性质,为解答该题的关键,该题有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.

 同步奥数系列答案
同步奥数系列答案| A. | HNO3 | B. | H2SO4 | C. | NaClO | D. | H3PO4 |
| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
| A. | 氨水属于化合物 | |
| B. | 一水合氨属于电解质 | |
| C. | 氨气溶于水时,只有极少数氨气与水结合生成一水合氨 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
| A. | H2、O2、SO2 | B. | CO2、H2S、Cl2 | C. | HCl、HBr、HI | D. | NH3、HCl、CO2 |
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
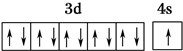 ,R在周期表中位于ds区.
,R在周期表中位于ds区.(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.