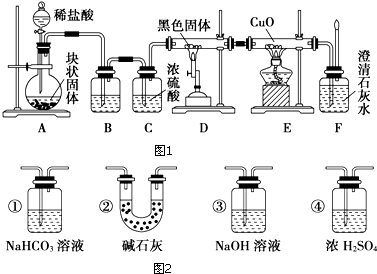
题目内容
11.下列途径不能得到晶体的是( )| A. | 熔融态物质快速冷却 | B. | 熔融态物质凝固 | ||
| C. | 气态物质凝华 | D. | 溶质从溶液中析出 |
分析 得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出,以此来解答.
解答 解:得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出;
A.熔融态物质急速冷却得到玻璃态物质,不属于晶体,故A错误;
B.从熔融态结晶出来的硫,符合途径①,故B正确;
C.气态物质凝华,符合途径②,故C正确;
D.溶质从溶液中析出,符合途径③,故D正确;
故选A.
点评 本题考查获得晶体的途径,明确获得晶体的三种常见途径是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
1.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 任何元素的原子都是由核外电子和核内中子、质子组成 | |
| D. | ${\;}_{17}^{35}Cl$与${\;}_{17}^{37}Cl$得电子能力相同 |
2.下列变化的实质相似的是( )
| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
19.下列各组气体中,在通常情况下既能共存,又能用浓硫酸干燥的是( )
| A. | H2、O2、SO2 | B. | CO2、H2S、Cl2 | C. | HCl、HBr、HI | D. | NH3、HCl、CO2 |
3.X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:
(1)R基态原子的价电子排布图为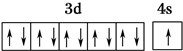 ,R在周期表中位于ds区.
,R在周期表中位于ds区.
(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
 ,R在周期表中位于ds区.
,R在周期表中位于ds区.(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
20.A、B、C、D、E、F为原子序数逐渐增大的短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)C的价电子排布式为2s22p3,写出一种工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,向足量的其水溶液中通入少量F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为Na2O2或Na2C2;b的电子式为 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.
(1)C的价电子排布式为2s22p3,写出一种工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,向足量的其水溶液中通入少量F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| b | 化学组成为BDF2 |
 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.