题目内容
5.下列各组中的两种物质相互作用时,改变反应条件或反应物的用量,不会影响产物的是( )| A. | 钠与氧气 | B. | 氢氧化钠和二氧化碳 | ||
| C. | 氢氧化钠和氯化铝 | D. | 氧化钠和二氧化碳 |
分析 A.钠在氧气中放置生成氧化钠,在氧气中点燃生成过氧化钠;
B.氢氧化钠和二氧化碳1:1反应生成碳酸氢钠,按照2:1反应生成碳酸钠;
C.氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
D.氧化钠和二氧化碳反应,无论二氧化碳是否过量,都只生成碳酸钠.
解答 解:A.钠在氧气中放置生成氧化钠,在氧气中点燃生成过氧化钠,反应条件不同产物不同,故A错误;
B.氢氧化钠和二氧化碳1:1反应生成碳酸氢钠,按照2:1反应生成碳酸钠,反应物用量不同,产物不同,故B错误;
C.氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,所以与反应物用量有关,故C不选;
D.无论二氧化碳是否过量,氧化钠和二氧化碳反应都只生成碳酸钠,所以与温度、反应物用量无关,故D选;
故选D.
点评 本题考查了反应条件或反应物的用量对反应的影响,题目难度不大,熟悉物质的性质是解题的关键.

练习册系列答案
相关题目
3.X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:
(1)R基态原子的价电子排布图为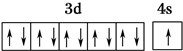 ,R在周期表中位于ds区.
,R在周期表中位于ds区.
(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
 ,R在周期表中位于ds区.
,R在周期表中位于ds区.(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
20.(1)下列化学用语均有错误,请将正确的化学用语填在相应的横线上
氯元素CLCl2个氮分子2N2N2铁离子 ${\;}_{Fe}^{+2}$+2价铁元素
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
氯元素CLCl2个氮分子2N2N2铁离子 ${\;}_{Fe}^{+2}$+2价铁元素
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
14.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A和C处于同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是( )
| A. | 原子半径A<B<C | |
| B. | A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体 | |
| C. | A单质的熔点高于C单质 | |
| D. | A与B或C均可形成离子化合物 |
15.下列离子方程式,正确的是( )
| A. | 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+Cl-+ClO- | |
| C. | 二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
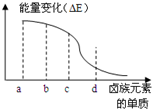 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题: