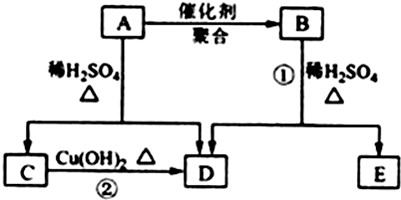
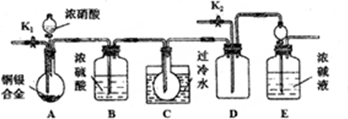
题目内容
12.将9g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.则下列说法正确的是( )| A. | 第一次剩余4.8g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0mol•L-1 | |
| C. | 原混合物中铜和铁各0.075mol | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12LNO |
分析 整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,再结合选项解答.
解答 解:整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、$\frac{2}{3}$(x+y)=$\frac{2.24}{22.4}$,联立方程,解得:x=0.075mol、y=0.075mol,
A.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故A错误;
B.根据方程式可知,n(HNO3)=0.075mol×$\frac{8}{3}$=0.2mol,稀硝酸的物质的量浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,故B错误;
C.由上述分析可知,原混合物中铜和铁各0.075mol,故C正确;
D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为:$\frac{0.075mol×1}{3}$=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故D错误;
故选C.
点评 本题考查混合物的有关计算,题目难度中等,利用整体法解答及判断最终的产物是关键,避免了过程法的繁琐,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

 53随堂测系列答案
53随堂测系列答案| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
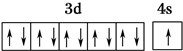 ,R在周期表中位于ds区.
,R在周期表中位于ds区.(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)含有元素Q的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量.
(4)Q单质形成的晶体的堆积模型为体心立方密堆积,配位数是8.
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
(1)C的价电子排布式为2s22p3,写出一种工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,向足量的其水溶液中通入少量F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| b | 化学组成为BDF2 |
 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2. | A. | 原子半径A<B<C | |
| B. | A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体 | |
| C. | A单质的熔点高于C单质 | |
| D. | A与B或C均可形成离子化合物 |
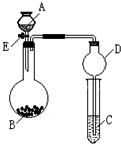 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: