题目内容
16.下列有关阿伏加德罗常数NA的叙述正确的是( )| A. | 1molCl2参加反应,不一定得到2NA个电子 | |
| B. | 标准状况下,将22.4LNO和11.2LO2混合后,可以得到NA个NO2分子 | |
| C. | 常沮常压下,1L0.1mol/LHF溶液中含有0.1NA个H+ | |
| D. | 25℃,1.7g羟基所含电子数为NA |
分析 A、氯气参加反应后的价态不明确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
C、HF为弱酸,在溶液中只能部分电离;
D、求出羟基的物质的量,然后根据-OH中含9个电子来分析.
解答 解:A、氯元素既有正价又有负价,而氯气参加反应后的价态不明确,故1mol氯气反应后不一定得电子,还可能失电子,故A正确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故所得的NO2分子个数小于NA个,故B错误;
C、HF为弱酸,在溶液中只能部分电离,故溶液的氢离子个数小于0.1NA个,故C错误;
D、1.7g羟基的物质的量为0.1mol,而-OH中含9个电子,故0.1mol-OH中含0.9NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
14. 如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
 如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )| A. | 甲中A处通入CH4,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 乙中电解MgCl2溶液的总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2 | |
| D. | 甲、乙中电解质溶液的pH都增大 |
4.a 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mo1•L-1,则该样品中氮的质量分数为18.85%.
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
8.氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH- 据此作出判断,下列说法中正确的是( )
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
5.下列各物质间的转化在给定条件下能实现的是( )
| A. | CH4$→_{光照}^{Cl_{2}}$HCl$\stackrel{NH_{3}}{→}$NH4Cl | |
| B. | CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{催化剂,△}^{O_{2}}$CH3CHO | |
| C. | 淀粉$→_{△}^{催化剂}$葡萄糖$→_{△}^{AgNO_{3}溶液}$银镜 | |
| D. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
6.下列说法正确的是( )
| A. | 常温下,将pH=4的CH3COOH溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动. |
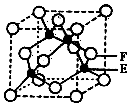 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题: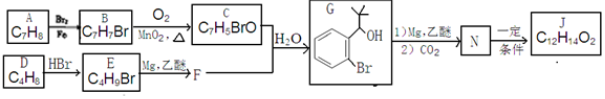

 .
.
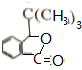
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.
 .
. .
.