题目内容
下列物质转化关系中,必须加入适当氧化剂才能实现的是( )
| A、PCl3→PCl5 |
| B、MnO4-→Mn2+ |
| C、SO3→SO42- |
| D、CO2→CO |
考点:氧化还原反应
专题:氧化还原反应专题
分析:必须加入适当氧化剂才能实现,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答:
解:A.P元素的化合价升高,则加入氧化剂实现,故A选;
B.Mn元素的化合价降低,则加入还原剂实现,故B不选;
C.S元素的化合价不变,不发生氧化还原反应,故C不选;
D.C元素的化合价降低,需要加入还原剂实现,故D不选;
故选A.
B.Mn元素的化合价降低,则加入还原剂实现,故B不选;
C.S元素的化合价不变,不发生氧化还原反应,故C不选;
D.C元素的化合价降低,需要加入还原剂实现,故D不选;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
银锌电池广泛用作各种电子仪器的电源,其充电和放电过程可以表示为:Ag2O+Zn+H2O
2Ag+Zn(OH)2,电池放电时,负极上发生反应的物质及电池充电时阴极发生反应的物质分别是( )
| 充电 |
| 放电 |
| A、Zn、Zn(OH)2 |
| B、Ag、Ag2O |
| C、Ag2O、Zn |
| D、Zn(OH)2、Ag2O |
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )


| A、1 mol A最多能与4 mol H2发生加成反应 |
| B、有机物A可以在一定条件下与HBr发生反应 |
| C、有机物A与浓硫酸混合加热,可以发生消去反应 |
| D、1 mol A与足量的NaOH溶液反应,最多可以消耗 2 mol NaOH |
下列有关说法正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 |
| C、升高温度通过降低活化能而加快化学反应速率 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
CO2↑+2H2O+2SO2↑,则12g木炭和足量的浓硫酸反应后生成的气体在标况下的体积为( )
| ||
| A、22.4 L |
| B、44.8 L |
| C、67.2 L |
| D、89.6 L |
足量的两份铝粉分别与等体积的盐酸和NaOH溶液反应,同温同压下产生的气体体积比为1:1,则盐酸和NaOH溶液的物质的量浓度之比为( )
| A、2:3 | B、3:1 |
| C、1:2 | D、1:1 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
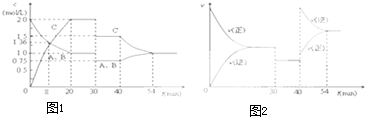

| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |