题目内容
18. 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).(2)乙同学将足量的铜粉投入50mL 18.4mol•L-1浓硫酸中并加热制取SO2,写出该反应的化学方程式:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
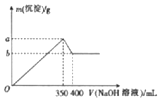
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol•L-1的NaOH溶液,并绘制出沉淀质最与NaOH溶液体积的关系图象(如图所示),则a=19.4.
分析 (1)Na与水反应生成NaOH和氢气,Al与NaOH溶液反应也生成氢气;
(2)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,Cu与稀硫酸不反应;
(3)在AlCl3和MgCl2的混合溶液中滴加NaOH溶液,生成的沉淀逐渐增加,当沉淀达到最大量后,氢氧化铝沉淀开始溶解,然后根据图象中数据列式计算即可.
解答 解:(1)钠与水发生的离子反应方程式为:2Na+2H2O═2Na++2OH-+H2↑,n(Na)=$\frac{4.6}{23}$=0.2mol,生成氢气的体积为0.1mol×22.4L/mol=2.24L,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,则充分反应生成的气体体积大于2.24L,
故答案为:大于;
(2)发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(H2SO4)=0.5L×18.4mol/L=9.2mol,由反应可知生成的SO2物质的量为4.6mol,但Cu与稀硫酸不反应,则生成的SO2物质的量小于4.6mol,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol;
(3)设氯化铝的物质的量浓度为x,氯化镁的浓度为y,
溶解氢氧化铝的反应为Al(OH)3+OH-═AlO2-+2H2O,总共消耗了400mL-350mL=50mLNaOH溶液,n(NaOH)=0.05L×2mol/L=0.1mol,则氢氧化铝的物质的量为0.1mol;生成沉淀最大时发生Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,共消耗NaOH为0.35L×2mol/L=0.7mol,则
Al3++3OH-=Al(OH)3↓
0.1mol 0.3mol 0.1mol
Mg2++2OH-=Mg(OH)2↓
0.2mol 0.4mol 0.2mol
则生成沉淀为0.1mol+0.2mol=0.3mol,
可知a=0.1mol×78g/mol+0.2mol×58g/mol=19.4
故答案为:19.4.
点评 本题考查金属及化合物的性质,为高频考点,把握发生的反应及现象、物质的量关系为解答的关键,侧重分析与应用、计算能力的考查,题目难度不大.

| A. | O2、H2 | B. | Cl2、HCl | C. | H2、Cl2 | D. | O2、HCl |
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
| A. | 氯化氢分子的电子式: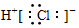 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: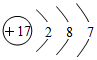 |