题目内容
17.“同位素示踪法,可帮助人们认识化学反应的机理.下列反应中同位素示踪表示正确的是( )| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| C. | NH4Cl+2H2O?NH3•2H2O+HCl | |
| D. | CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O |
分析 A.过氧化物与水反应实质为,过氧根离子结合水提供的氢离子生成过氧化氢,同时生成氢氧化钠,过氧化氢在碱性条件下不稳定,分解为水和氧气;
B.KClO3和HCl发生归中反应,化合价变化不能出现交叉价态;
C.NH3•2H2O电离出铵根离子和的氢氧根;
D.乙醇与乙酸反应酯化反应,反应中乙醇断裂O-H键,乙酸断裂C-O键.
解答 解:A.过氧化物与水反应实质为:过氧根离子结合水提供的氢离子生成过氧化氢,同时生成氢氧化钠,过氧化氢在碱性碱性条件下不稳定,分解为水和氧气,反应方程式为:2Na218O2+4H2O=4NaOH+18O2↑+2H218O,所以18O同时在水中和氧气中,不出现在氢氧化钠中,故A错误;
B.K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O,KClO3中氯元素由+5价降低为0价,HCl中氯元素化合价由-1价升高为0价,故37Cl应在氯气中,故B错误;
C.NH3•2H2O电离出铵根离子和的氢氧根,与盐酸反应后2H应同时存在于氯化铵中和水中,故C错误;
D.乙醇与乙酸反应酯化反应,反应中乙醇断裂O-H键,乙酸断裂C-O键,18O在乙酸乙酯分子中,反应机理为CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,故D正确.
故选D.
点评 本题以化学反应机理探究为载体,考查氧化还原反应、盐类水解等,难度中等,是对知识的综合能力的考查,A选项为易错点,容易认为氢氧化钠中的氧来自过氧化钠.

练习册系列答案
相关题目
12.有机物X的结构简式为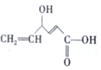 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )
 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )| A. | X中有4种官能团 | |
| B. | X的分子式为C6H5O3 | |
| C. | X可发生氧化、取代、加成反应 | |
| D. | 1molX与足量钠反应可生成11.2L气体(标准状况) |
2.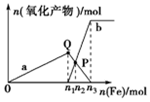 含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
 含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )| A. | 曲线a表示Fe2+,曲线b表示Fe3+ | |
| B. | P点时总反应的离子方程式可表示为5Fe+16H++4NO3-═3Fe2++2Fe3++4NO↑+8H2O | |
| C. | n2=0.3 | |
| D. | n3:n1=3:1 |
9.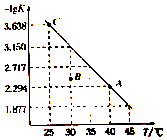 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |
6.下列有机反应中属于加成反应的是( )
| A. | 苯和液溴在FeBr3催化作用下反应生成溴苯 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯与HC1气体反应生成一氯乙烷 | |
| D. | 丙烯和氯气在一定条件下反应生成ClCH2CH═CH2 |
6.125℃时在容积不变的容器中:W、X、Y、Z的浓度变化如表:下列叙述中正确的是( )
| 物质 | W(g) | X(g) | Y(g) | Z(g) |
| 初始浓度(mol/L) | 4.0 | 2.0 | 0 | 0 |
| 2min末浓度(mol/L) | 2.4 | 1.2 | 0.8 | 1.6 |
| A. | 2min内X的平均速率为0.6mol/(L•min) | |
| B. | 该反应的化学方程式可表示为:2W(g)+X(g)?2Y+Z | |
| C. | 若达到平衡后保持压强不变充入Ne,平衡不移动 | |
| D. | 平衡后再加入W,则W的转化率增大 |
 .常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.
.常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.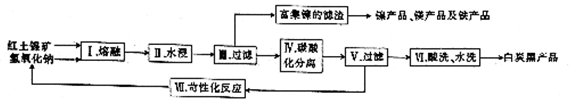
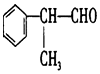 ,该物质是一种香料.
,该物质是一种香料.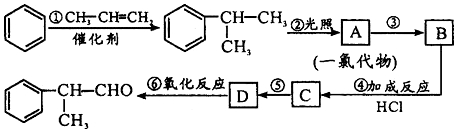
 ;
; ;⑥2
;⑥2 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2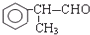 +2H2O.
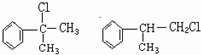
+2H2O.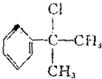 的水解产物
的水解产物 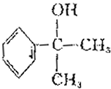 中的-OH不在链端,不能氧化成-CHO.
中的-OH不在链端,不能氧化成-CHO.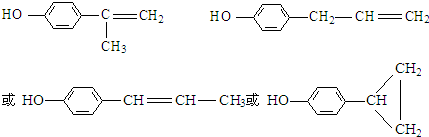 .
.