题目内容
20.下列物质的工业生产原理不涉及氧化还原反应的是( )| A. | 氨气 | B. | 纯碱 | C. | 硫酸 | D. | 烧碱 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,据此对各选项进行判断.
解答 解:A.工业制用氮气与氢气反应制取氨气,属于氧化还原反应,故A不选;
B.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
C.硫酸工业中存在S~SO2~SO3的转化,化合价发生变化,为氧化还原反应,故C不选;
D.工业制取烧碱涉及的反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故D不选;
故选B.
点评 本题考查了化学反应方程式的书写,明确物质的性质是解本题关键,注意掌握氧化还原反应的实质与特征,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.下列元素中,2017年最新命名的卤族元素是( )
| A. | Ts 钿 | B. | Si 硅 | C. | Br 溴 | D. | I 碘 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,44.8L NO与22.4L O2反应后的分子数是2NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 0.5mol苯乙烯( 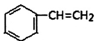 )中含有碳碳双键的数目为2NA )中含有碳碳双键的数目为2NA |
15.已知HCl的沸点为-85℃,则HI的沸点可能为( )
| A. | -167℃ | B. | -87℃ | C. | -35℃ | D. | 50℃ |
12.有机物X的结构简式为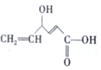 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )
 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )| A. | X中有4种官能团 | |
| B. | X的分子式为C6H5O3 | |
| C. | X可发生氧化、取代、加成反应 | |
| D. | 1molX与足量钠反应可生成11.2L气体(标准状况) |
9.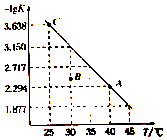 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |
10.火山爆发产生的气体中含有少量的羰基硫(分子式是:COS),已知羰基硫分子结构与CO2类似,有关说法正确的是( )
| A. | 羰基硫是电解质 | B. | 羰基硫分子的电子式为: | ||
| C. | C、O、S三个原子中半径最小的是C | D. | 羰基硫分子为非极性分子 |
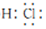 .常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.
.常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.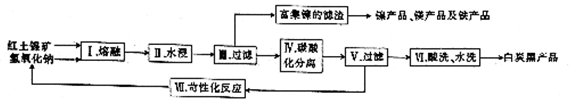
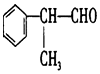 ,该物质是一种香料.
,该物质是一种香料.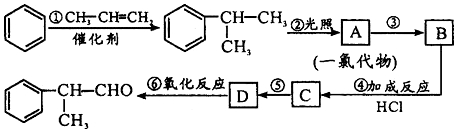
 ;
; ;⑥2
;⑥2 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2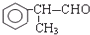 +2H2O.
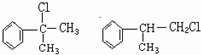
+2H2O.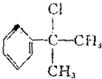 的水解产物
的水解产物 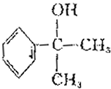 中的-OH不在链端,不能氧化成-CHO.
中的-OH不在链端,不能氧化成-CHO.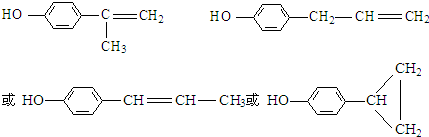 .
.