题目内容
19.化学与生产、生活密切相关,下列与化学有关的说法正确的是( )| A. | 生理盐水和A1(OH)3胶体的本质区别是能否产生丁达尔效应 | |
| B. | 纤维素和聚氯乙烯均为可降解的高分子化合物 | |
| C. | 水晶项链和玻璃杯均属于硅酸盐产品 | |
| D. | 耐蚀合金的防腐原理与电化学无关 |
分析 A.不同分散系本质区别分散质粒度大小;
B.聚氯乙烯不能降低;
C.水晶主要成分二氧化硅;
D.合金的防腐是改变金属内部结构.
解答 解:A.生理盐水和A1(OH)3胶体的本质区别是分散质粒度大小,生理盐水为溶液分散质粒度小于1nm,氢氧化铝胶体分散质粒度介于1nm-100nm,故A错误;
B.聚氯乙烯不能降低,大量使用能引起白色污染,故B错误;
C.水晶主要成分二氧化硅,属于氧化物,不是硅酸盐,故C错误;
D.耐蚀合金的防腐原理是改变物质的内部结构,与电化学无关,故D正确;
故选:D.
点评 本题考查了化学与生产生活,涉及分散系本质特征、元素化合物性质与用途、金属的腐蚀与防护,题目难度不大,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
9.表为元素周期表的一部分.
请判断 X、Y、Z,并用相应的元素符号回答下列问题.
(1)X是Si,它的原子M层电子数是4.
(2)表中元素原子半径最大的是Si.
(3)Y在元素周期表中的位置是第二周期第ⅥA族,用电子式表示Y的最简单氢化物的形成过程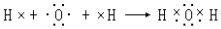 .
.
(4)氮气中氮原子之间的化学键属于共价键键,由氮气与氢气反应生成1mol氨气时转移电子的数目是3NA.
(5)硫与Z两种元素相比,非金属性强的是Cl,请用化学方程式说明这一结论H2S+Cl2=S↓+2HCl.
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是H2O>NH3>CH4.由最高价碳元素与最低价氮元素组成化合物的化学式是C3N4.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)X是Si,它的原子M层电子数是4.
(2)表中元素原子半径最大的是Si.
(3)Y在元素周期表中的位置是第二周期第ⅥA族,用电子式表示Y的最简单氢化物的形成过程
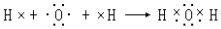 .
.(4)氮气中氮原子之间的化学键属于共价键键,由氮气与氢气反应生成1mol氨气时转移电子的数目是3NA.
(5)硫与Z两种元素相比,非金属性强的是Cl,请用化学方程式说明这一结论H2S+Cl2=S↓+2HCl.
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是H2O>NH3>CH4.由最高价碳元素与最低价氮元素组成化合物的化学式是C3N4.
10.下列元素中,2017年最新命名的卤族元素是( )
| A. | Ts 钿 | B. | Si 硅 | C. | Br 溴 | D. | I 碘 |
14.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )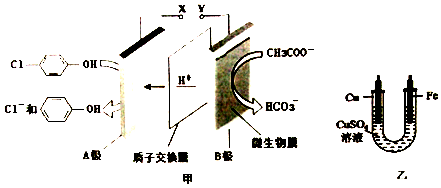
 ),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
| A. | 铁电极应与Y相连接 | |
| B. | 反应过程中甲中右边区域溶液pH逐渐升高 | |
| C. | A极的电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | |
| D. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1NA |
4.有机物M、N、Q的转化关系为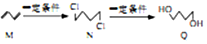 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M至N的反应类型是取代反应 | |
| B. | N的同分异构体有6种 | |
| C. | 可用酸性KMnO4溶液区分N与Q | |
| D. | 0.3molQ与足量金属钠反应生成0.15NA个H2 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,44.8L NO与22.4L O2反应后的分子数是2NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 0.5mol苯乙烯( 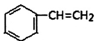 )中含有碳碳双键的数目为2NA )中含有碳碳双键的数目为2NA |
9.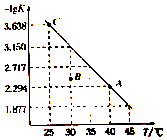 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |
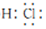 .常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.
.常温下Na2SiO3溶液的pH>(填“>”“<”或“=”) 7. ②用化学方程式表示该制备原理:2HCl+Na2SiO3+(n-1)H2O=SiO2•nH2O↓+2NaCl.